
背景:
强制性表达转录因子OCT4、SOX2、KLF4和c-MYC(OSKM)可将体细胞重编程为诱导多能干细胞(IPSC)。在重编程开始时,外源OSKM与整个基因组的DNA结合,并诱导连续几轮染色质重组,从而激活整个多能性基因网络。然而,OSKM不是孤立运作的,需要与共同的调节者(共激活因子和共抑制因子)合作来有效重塑表观遗传环境,但这种相互作用是如何调节的,目前仍知之甚少。
内容概述:
2018年6月,中国科学院广州生物医药与健康研究院再生生物学重点实验室在国际期刊Nature Cell Biology(IF2017=19.064)上发表了题为“NCoR/SMRT co-repressors cooperate with c-MYC to create an epigenetic barrier to somatic cell reprogramming“的最新论文,首次发现NCoR/SMRT共抑制子通过其核心表观遗传亚基“组蛋白去乙酰化酶3(HDAC3) ”,去除基因组多能基因位点上的“活性标记”H3K27ac,从而抑制四个山中因子(OCT4、SOX2、KLF4和c-MYC)介导的重新编程。此外,山中因子中的c-MYC可以募集NCoR/SMRT-HDAC3到基因组位点,有助于解释“为什么包含c-MYC的重编程体系更容易产生不完全重编程”的现象。本研究不仅揭示了NCoR/SMRT共抑制子在重编程中的作用,而且提出了c-MYC在这一过程中的双重功能。
主要技术:
RNA-seq、ChIP、Co-IP、基因过表达/干扰等;
辉骏生物为本研究提供了蛋白检测和分析服务。
研究路线:

研究结果:
1. NCoR/SMRT抑制OSKM重编程
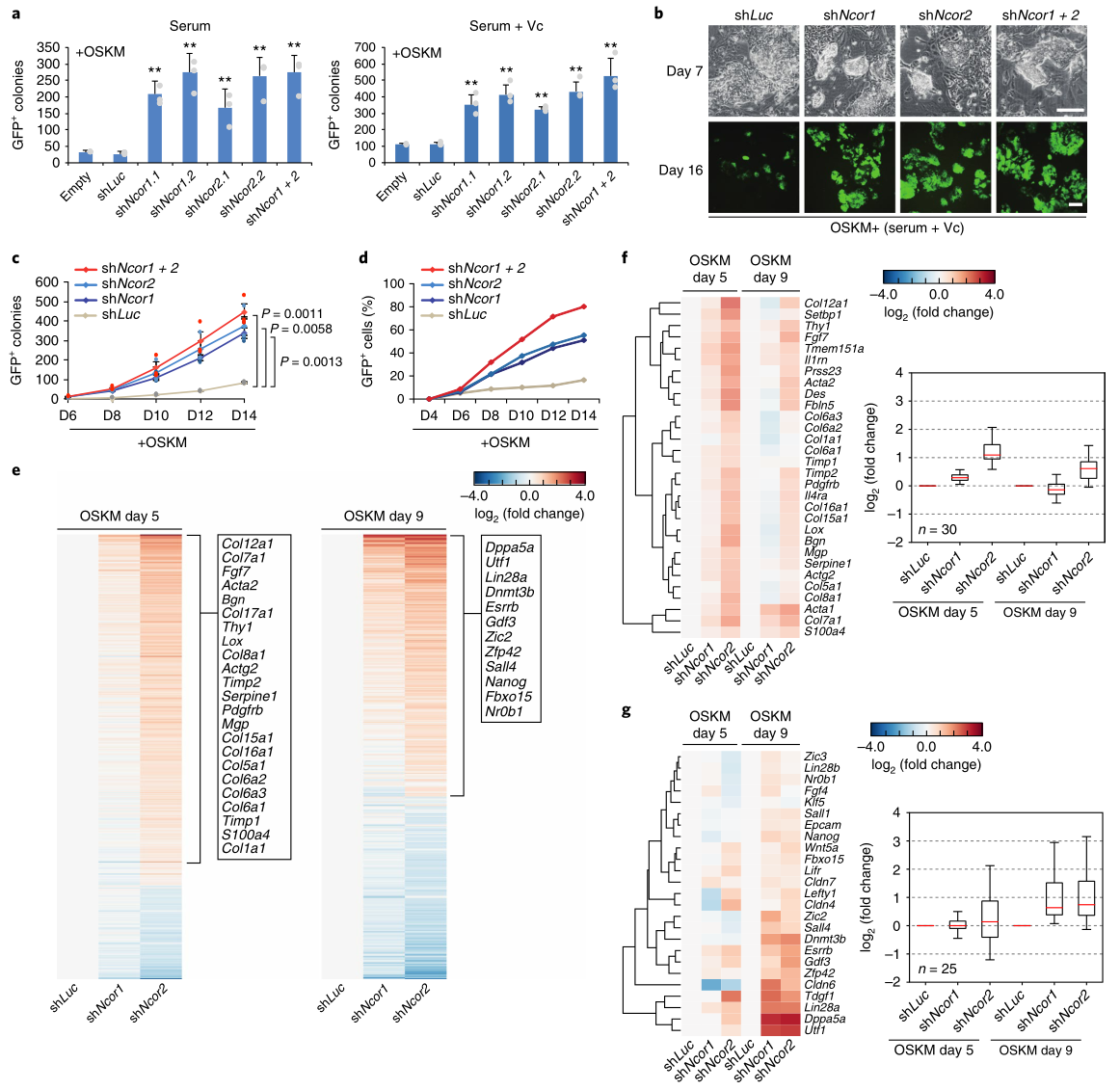
首先,研究者首先发现Ncor1(编码NCoR)和Ncor2(编码SMRT)在小鼠胚胎成纤维细胞(MEF)、胚胎干细胞(ESC)和OSKM重编程细胞中均有表达。无论用怎样的转导方法、报告系统、MEF类型或培养基,抑制Ncor1/2的表达都能增强OSKM诱导的重编程(图1a-c)。
RNA-seq发现Ncor1/2敲除细胞在OSKM重编程时的基因表达谱很相似(图1e),但Ncor2敲除的整体效应更强(图1e)。许多体细胞基因在OSKM 第5天上调,在第9天变得不明显(图1f),而与间充质-上皮转化有关的基因在这两个时间点都没有受到影响。OSKM第9天出现了多能基因的上调。这些结果表明,在OSKM重编程中敲除Ncor1/2先是暂时减弱了对体细胞基因的抑制,接着是加快和更有效地激活多能性基因。
2. NCoR/SMRT共抑制因子需要HDAC3来破坏重新编程
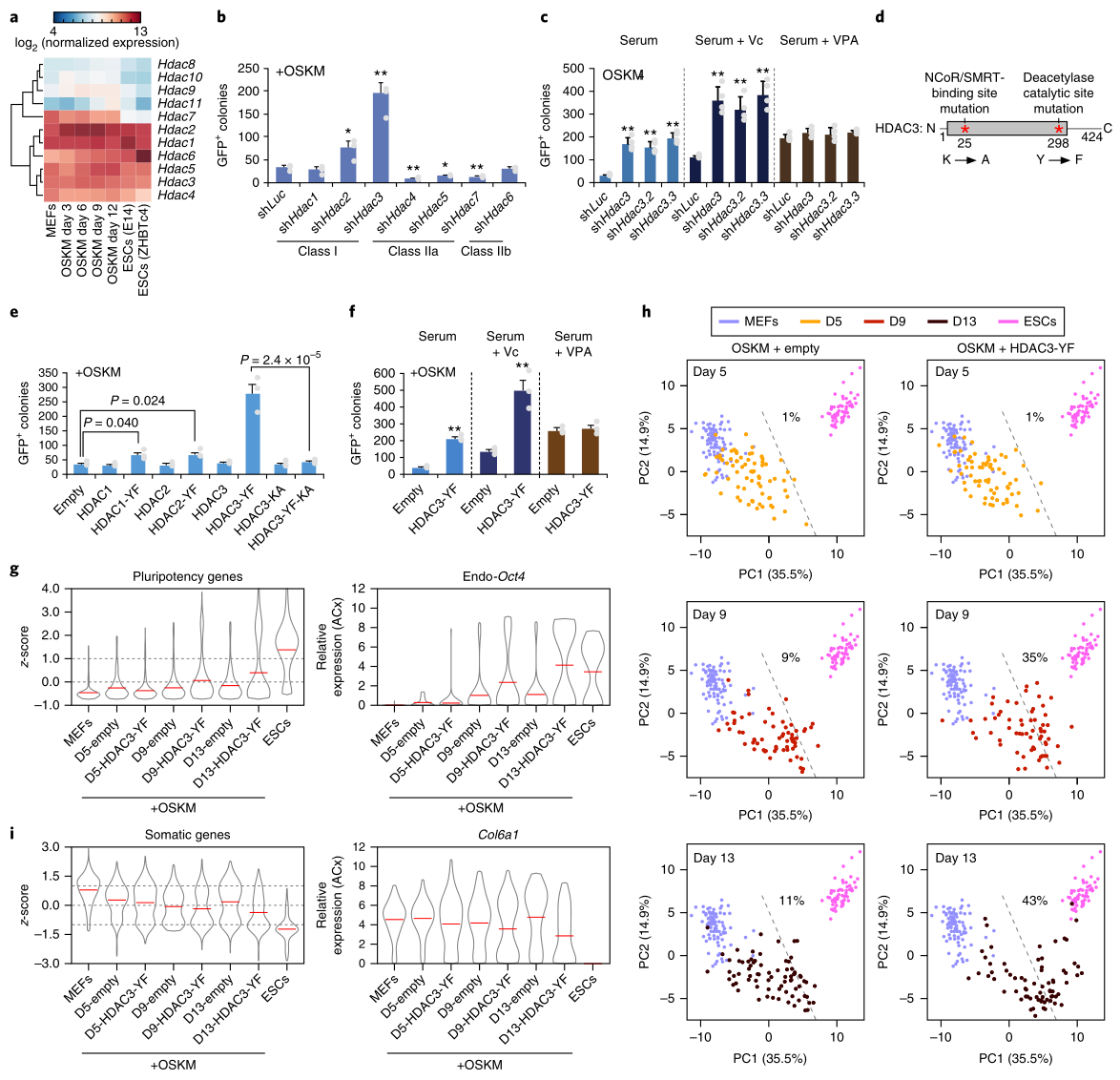
NCoR和SMRT可以通过转录因子和表观遗传修饰因子(如组蛋白脱乙酰酶HDAC)调控染色质。泛HDAC抑制剂(VPA和TSA)能促进重编程,因此推测HDAC可能参与NCoR/SMRT抑制OSKM重编程的过程。据报道,HDAC1、2、3、4、5、7都能与NCoR/SMRT相互作用,因此研究人员全面检测了HDAC1到HDAC11在MEF、ESC和OSKM重编程细胞中的表达:HDAC1到HDAC6在三类细胞中都有表达(图2a)。接着,他们研究了敲除HDAC的效果,发现只有HDAC3敲除显著促进了重编程 (图2b)。此外,VPA的加入不影响HDAC3敲除细胞的重编程(图2c),表明泛HDAC抑制剂通过抑制HDAC3促进OSKM重编程。接下来,研究者制备了2个HDAC3突变体HDAC3-YF(缺乏去乙酰酶活性)和HDAC3-YF-KA(既缺乏去乙酰酶活性,也缺乏结合NCoR/SMRT的能力)(图2d);同时以HDAC1-YF和HDAC2-YF做对照。结果显示,过表达HDAC3-YF显著增强了OSKM重编程(图2e);VPA不影响HDAC3-YF重编程的程度(图2f);HDAC3-YF-KA突变体不再促进重编程,表明HDAC3-YF需要结合NCoR/SMRT来发挥作用 (图2d,e)。另外,HDAC3-YF过表达细胞重编程的第9和13天(尤其是第13天),许多多能基因的表达都升。
这些结果表明,HDAC3介导的NCoR/SMRT对OSKM重编程的抑制需要去乙酰酶活性;但是抑制NCoR/SMRT或HDAC3对体细胞基因的影响不同,这可能是由于靶位点上NCoR/SMRT的缺失影响了其他酶的活性,或是招募了一些激活因子。
3. HDAC3通过诱导多能基因位点的组蛋白去乙酰化来抑制重编程
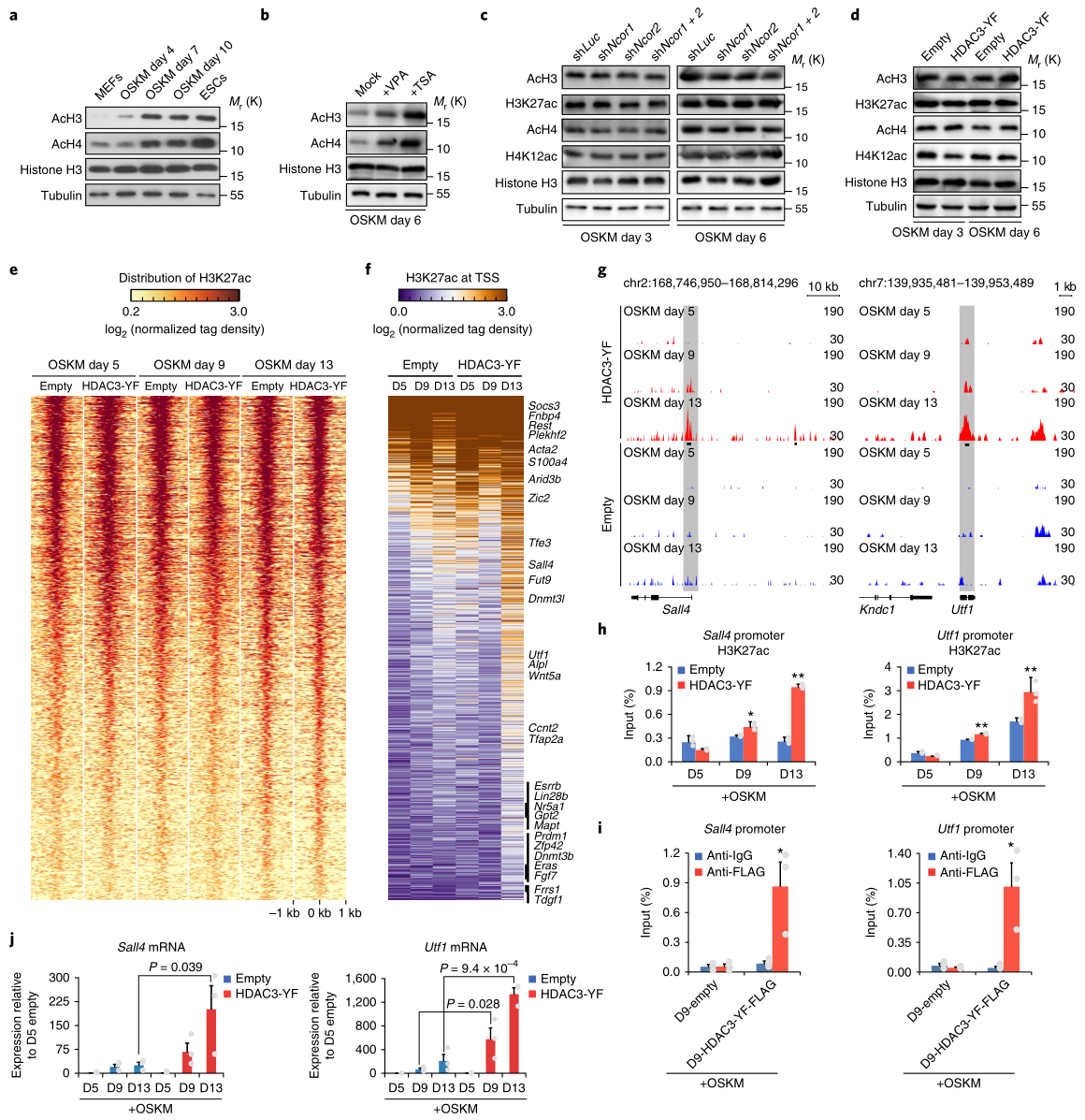
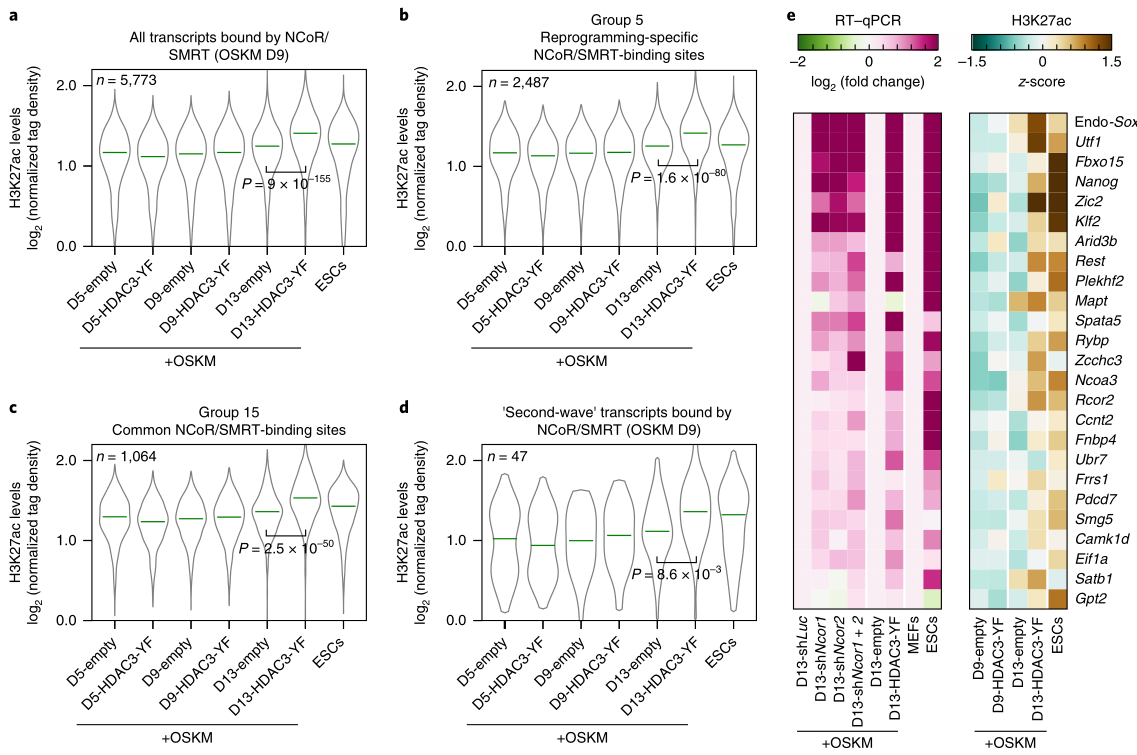
接着,研究者发现组蛋白H3乙酰化(AcH3)和组蛋白H4乙酰化(AcH4)在ESC中的水平均高于MEF(图3a);在VPA或TSA增强的OSKM重编程细胞中,其水平也均有增加(图3b),但是在NCoR/SMRT缺失或HDAC3-YF过表达的OSKM重编程细胞中,它们的水平没有增加,另外受NCoR/SMRT-HDAC3调控的代表性的乙酰化组蛋白H3K27ac和H4K12ac的水平也没有增加(图3c,d)。
接着,HDAC3-YF诱导OSKM重编程的细胞进行了H3K27ac 的ChIP-seq实验,研究组蛋白乙酰化的整体影响(图3e)。结果显示,大多数H3K27ac位于转录起始位点(TSS)附近。之后的检测进一步发现,H3K27ac水平较高的多为多能性相关基因(图3f);在重编程后期,4个多能基因座(Sall4、Utf1、Nanog和Zic2)都表现出H3K27ac的增加(图3g),H3K27ac的ChIP-qPCR验证了这一结果(图3h);在重编程的第9天,HDAC3-YF 的ChIP-qPCR(图3i)也发现这些基因座被显著富集了(图3i),表明HDAC3-YF过表达直接影响OSKM重编程中H3K27ac的水平,H3K27ac的水平与这些多能基因的水平呈相关性(图3j)。
综上所述,HDAC3可能作为NCoR/SMRT复合体的一部分,使特定基因位点(如多能基因位点)发生组蛋白去乙酰化,从而抑制OSKM重编程。
4. NCoR/SMRT通过HDAC3介导的组蛋白去乙酰化抑制多能性基因激活
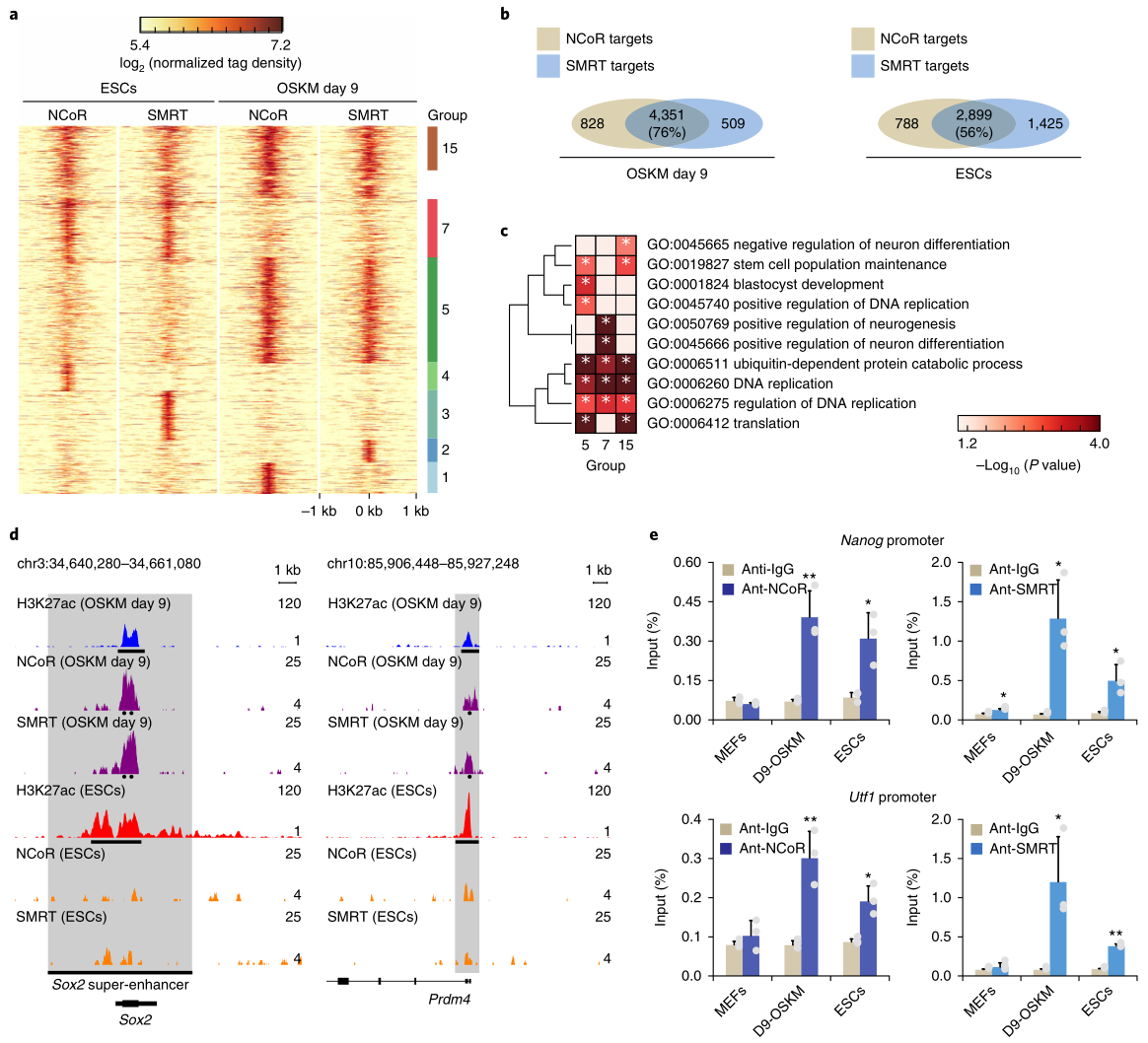
研究者对OSKM重编程细胞进行了NCoR/SMRT的CHIP Seq实验,结果显示,在ESC和重编程细胞中,NCoR与SMRT的结合峰有很多重叠的(图4a,b),这些峰大多位于TSS附近,这与H3K27ac的ChIP-seq数据一致。GO分析显示,重编程特有的结合峰或重编程与ESC细胞共有的结合峰,大多与干细胞相关(图4c),例如多能性基因Sox2和Prdm4仅在重编程细胞中与NCoR/SMRT结合,且这些基因座的H3K27ac水平在重编程中比ESC中更低(图4d),与之前认为NCoR/SMRT通过HDAC3去乙酰化的作用来抑制重编程的结论相符。ChIP-qPCR证实了在重编程时NCoR/SMRT与Nanog和Utf1启动子结合,而在ESC中的结合较少(图4e),在MEF中几乎不能结合。ESC特有的NCoR/SMRT结合峰,大多与分化相关(图4c),但敲除NCoR/SMRT并不能诱导分化。
这些结果表明,NCoR/SMRT被招募到多能基因位点抑制重编程,但在ESC中,它们具有不同的功能,这可能与发育过程中的组织特异性有关。
重编程中NCoR/SMRT的招募与H3K27ac水平呈反相关,在重编程为多能细胞时伴随着H3K27ac水平的升高。为了确定这一发现是否适用于所有的NCoR/SMRT结合基因,以及HDAC3-YF过表达是否有助于增加NCoR/SMRT靶位点的H3K27ac水平,他们在HDAC3-YF/空载诱导重编程细胞以及ESC细胞中,检测了NCoR/SMRT靶位点的H3K27ac水平,发现重编程第5天的H3K27ac水平较低,在第13天最高(图5a-d),其中HDAC3-YF过表达组上调更明显;另外ESC中的H3K27ac水平也较高。之后,他们对NCoR/SMRT结合的一组多能基因在TSS的2kb范围内进行了qPCR。发现无论过表达HDAC3-YF或敲除Ncor1/2时,重编程过程中H3K27ac水平的升高与多能基因表达的增加均有很好的相关性(图5e)。这些结果证实了NCoR/SMRT通过HDAC3介导的组蛋白去乙酰化来抑制多能性基因的激活。
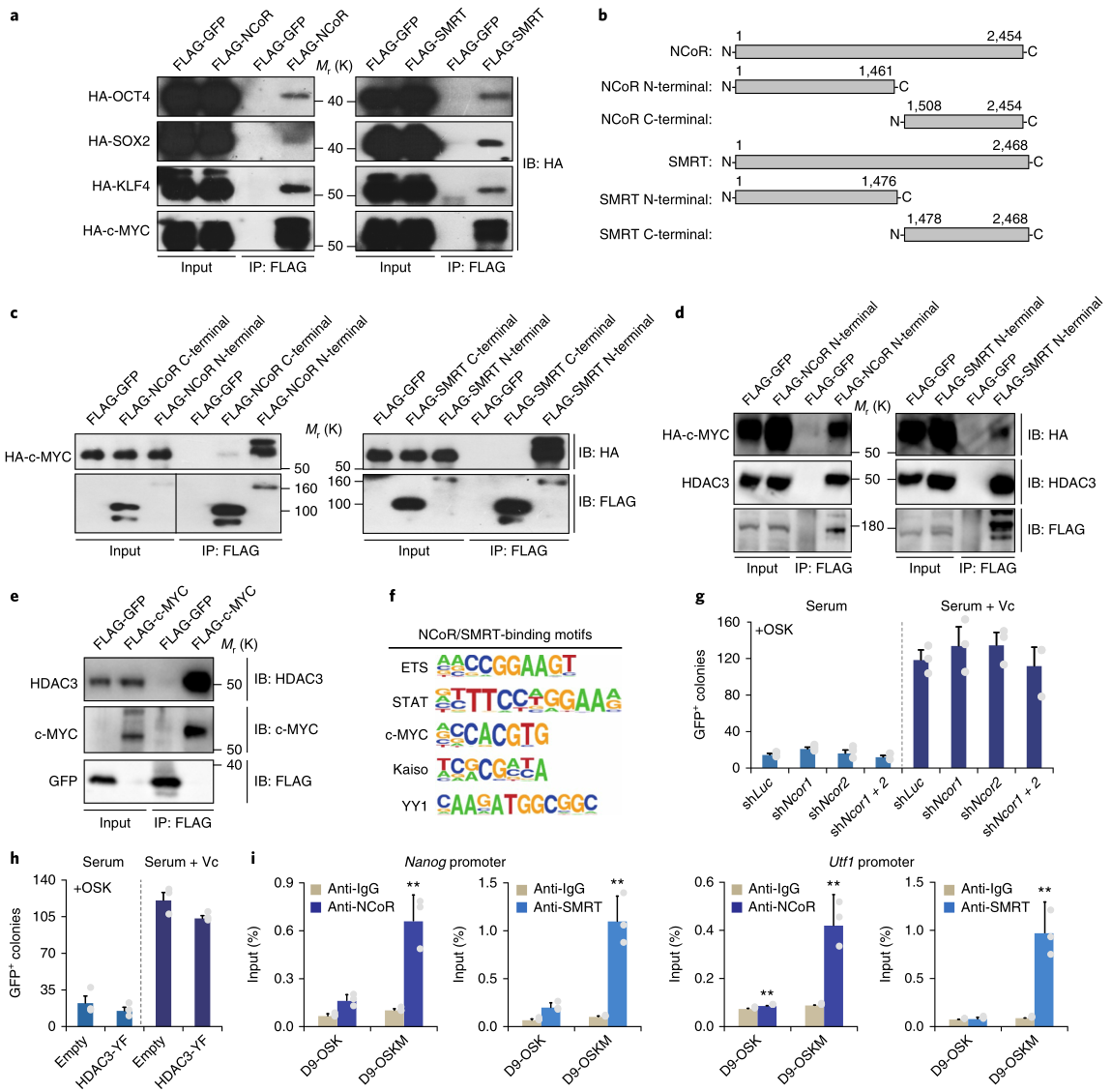
5. c-MYC在重编程时招募了NCoR/SMRT-HDAC3复合体
外源OSKM因子可能参与了NCoR/SMRT-HDAC3与特定基因位点的结合。HEK293T细胞的免疫共沉淀(Co-IP)证实了OSKM4个因子均与NCoR/SMRT相互作用,其中c-MYC的结合更强(图6a);NCoR/SMRT的N端结构域是c-MYC-NCoR/SMRT相互作用所必需的 (图6b,c)。CoIP实验表明,NCoR/SMRT的N端结构域可以共沉淀c-MYC和内源性的HDAC3 (图6d),外源性c-MYC可以共沉淀内源性的HDAC3(图6e),说明HDAC3可以和c-MYC-NCoR/SMRT相互作用。ChIP-seq分析发现,NCoR/SMRT中还存在着一个c-MYC结合基序(图6f)。此外,NCoR1/2基因敲除未能提高OSK的重编程效率(图6g),HDAC3-YF的表达对OSK的重编程也没有有利影响(图6h);NCoR/SMRT的ChIP–qPCR表明,Nanog和Utf1位点在OSK诱导的重编程中不能被富集(图6i)。
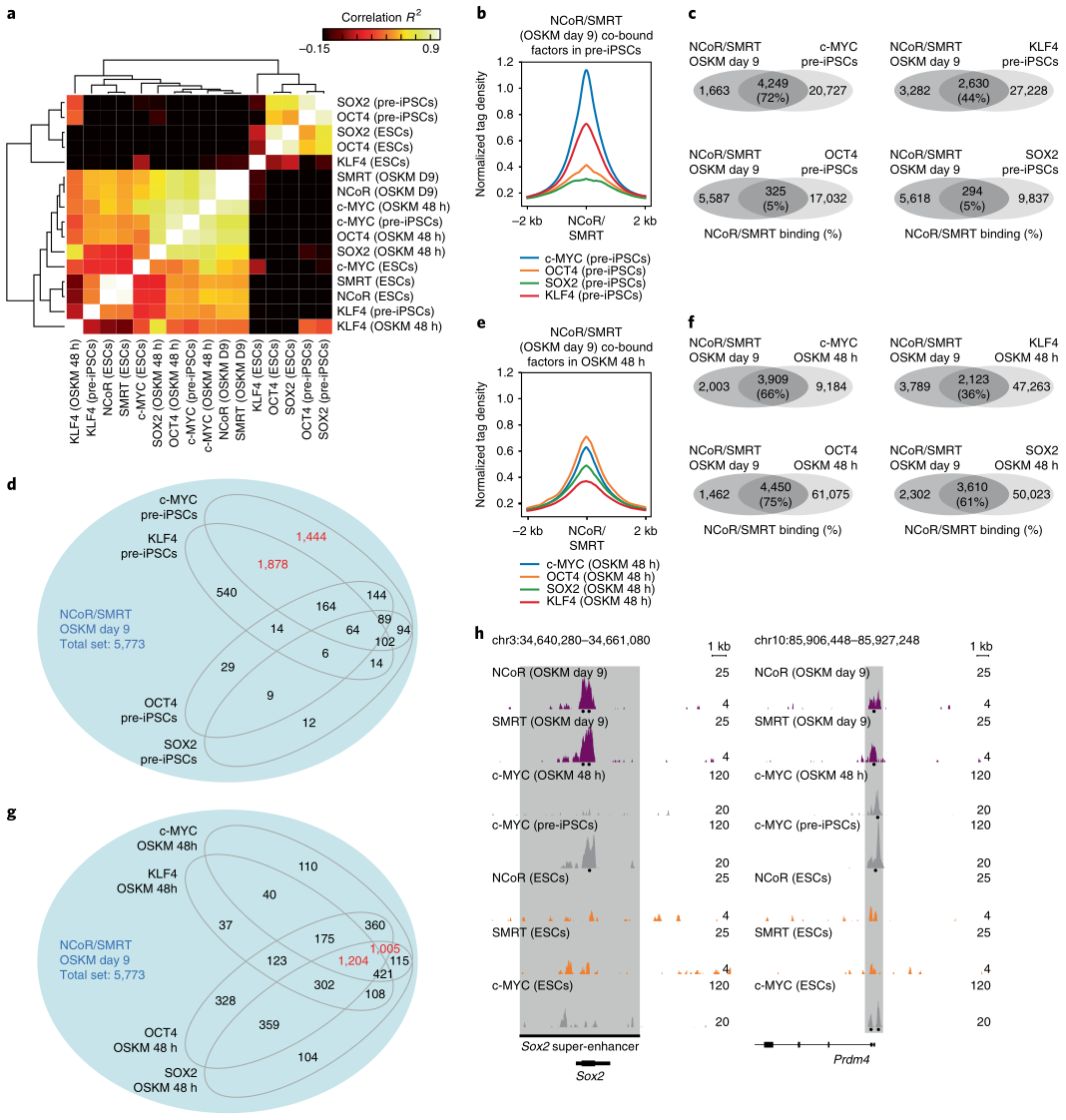
根据NCoR/SMRT的ChIP-seq数据及其GEO库下载的(OSKM四因子在pre-iPSCs, 48h OSKM重编程和ESC细胞的)ChIP–seq数据,研究者分析了NCoR/SMRT和OSKM四因子的结合位点相关性(图7a),在pre-iPSCs中,NCoR/SMRT与c-MYC的结合位点重叠最高,其次是KLF4和OCT4/SOX2(图7b,c),其中KLF4重叠位点大部分也与c-MYC结合 (图7d),说明c-MYC可能招募了NCoR/SMRT到这些位点。在48h OSKM重编程细胞中,NCoR/SMRT与OCT4、SOX2和c-MYC的结合位点都有大概60-70%的重叠,并且这些位点大部分是三因子共有的(图7e-g)。86%的c-MYC重叠位点在iPSCs中也存在,说明c-myc在重编程早期招募了NCoR/SMRT到这些位点,GO富集分析显示,这些位点基因富集在干细胞或囊胚相关的条目里。相反,9天OSKM重编程和ESCs中的NCoR/SMRT结合位点与ESCs中c-MYC(或OSK)的没有太多重叠,说明NCoR/SMRT在重编程和ESCs中具有不同的功能。
综上,在四个山中因子中,c-MYC最有助于将NCoR/SMRT募集到基因组位点(包括多能性位点),从而对重编程产生负面影响。
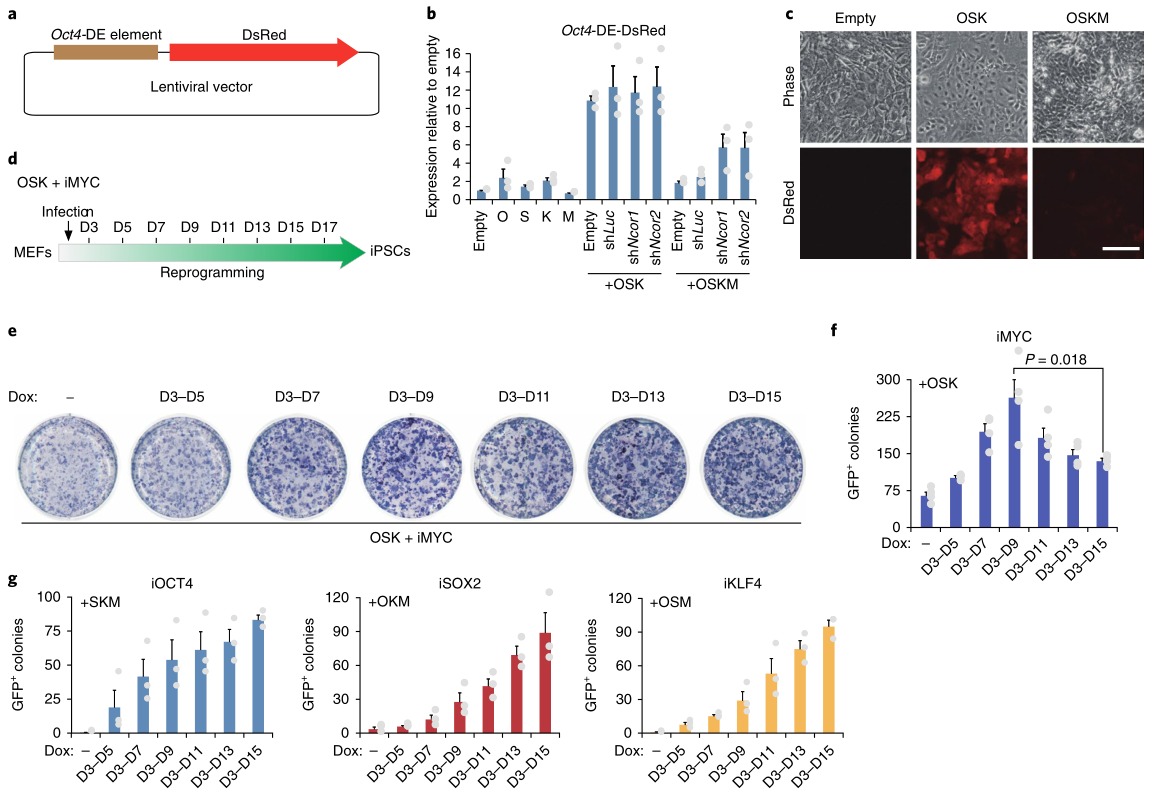
6. 外源c-MYC在重编程中的双重作用
为了进一步评估c-MYC和NCoR/SMRT在重编程中抑制多能基因的作用关系,研究者制备了由Oct4末端增强子(Oct4-DE)驱动的DsRed报告基因慢病毒 (图8a)并整合到细胞基因组,发现OCT4、SOX2或KLF4在MEF中的单独过表达略微激活了报告因子,但它们的组合具有协同作用(图8b,c)。相比之下,c-MYC单独没有激活作用,但与OSK结合使用会削弱报告基因活性的增加(图8b,c),Ncor1/2的敲除部分缓解了c-MYC对报告基因的抑制(图8b),这些结果表明,c-MYC募集NCoR/SMRT共抑制子到多能基因位点将不利于重编程,但这与之前的研究OSKM可诱导重编程的结论不一致。因此,研究者进一步用OSK和多西环素诱导的c-MYC重编程MEF(图8d)。c-MYC诱导的第3-9天,干细胞标记物碱性磷酸酶阳性的细胞数量达到峰值,不会随着时间延长进一步增加(图8e)。c-MYC诱导后第3-9天Oct4-GFP+细胞数量也达到高峰,但随着诱导时间延长明显减少(图8f);相反,OSK三因子的诱导在重编程的所有阶段都是有益的。这些结果表明,外源性c-MYC通过招募NCoR/SMRT-HDAC3抑制多能基因对重编程晚期是不利的。
结论:
本研究发现NCoR/SMRT–HDAC3共抑制复合物通过与OSKM因子(尤其是c-MYC)相互作用为重编程制造障碍,这一发现揭示了c-MYC在重编程中的双重作用,也有助于解释为何用OSKM而非OSK诱导重编程更容易产生pre-iPSCs,以及为何用HDAC抑制剂对OSKM而非OSK诱导的重编程能产生更强的效果等问题。









 实验热线:4006991663
实验热线:4006991663












