中文标题:STAT3的激活在TLR4信号介导的黑色素瘤进展中是一个关键事件
发表期刊:Cell Death and Disease
中科院分区:1区
影响因子:9.2
发表时间:2020年
合作单位:香港浸会大学中医学院
运用技术:慢病毒载体构建,慢病毒包装(由辉骏生物提供技术支持)
● 研究背景
黑色素瘤起源于神经嵴来源的黑素细胞,是一种侵袭性癌症,恶化速度快,致死率高。其发病机制十分复杂,到目前为止还没有完全阐明。尽管目前针对不能切除的黑色素瘤的靶向治疗和免疫治疗显示出令人振奋的临床效果,但这种疾病仍然是无法治愈的。了解黑色素瘤进展的机制将大大促进对抗黑色素瘤的新疗法的发展。
Toll样受体4(TLR4)是一种负责清除病原体的信号分子。它还与包括黑色素瘤在内的多种癌症的发生有关。脂多糖(LPS)是一种TLR4配体,它能促进TLR4阳性黑色素瘤细胞的增殖和迁移,而对TLR4阴性黑色素瘤细胞则无此作用。然而,TLR4信号介导的黑色素瘤发生机制尚不完全清楚。信号转导和转录激活因子3(STAT3)是一种转录因子,在黑色素瘤中被结构性激活。STAT3的激活/磷酸化导致一组与黑色素瘤生长、血管生成、转移和免疫逃避有关的基因转录。在结肠癌患者的肿瘤组织中,已发现TLR4、MyD88和STAT3的表达呈正相关,然而有关是否存在涉及这三个分子的通路以及其在大肠癌中是否起致病作用尚不清楚。
● 研究结果
1. 人黑色素瘤标本中TLR4表达与STAT3磷酸化呈正相关
为了确定TLR4的表达与STAT3激活/磷酸化的相关性,研究者利用人类黑色素瘤组织(总共208个样本)进行了免疫组织化学染色(图1A)。使用H评分系统对蛋白质表达水平进行半定量评估,结果显示与正常组织相比,黑色素瘤组织中TLR4和磷酸化STAT3(Y705)的蛋白水平显著升高(图1B,C)。进一步分析表明,208例黑色素瘤组织中TLR4的表达和STAT3的磷酸化水平呈正相关(图1D)。在男性和女性患者样本中也发现TLR4表达和STAT3磷酸化呈正相关;在不同年龄组中,TLR4表达与STAT3磷酸化在中年(40-60岁)和老年(>60岁)患者中呈正相关,而在年轻(<40岁)患者中无相关性。<40岁患者与≥40岁患者观察结果不同的原因有待进一步探讨。总之,TLR4和STAT3在人黑色素瘤组织中的高水平表达和STAT3磷酸化呈正相关,提示TLR4和STAT3在黑色素瘤发病机制中存在联系。
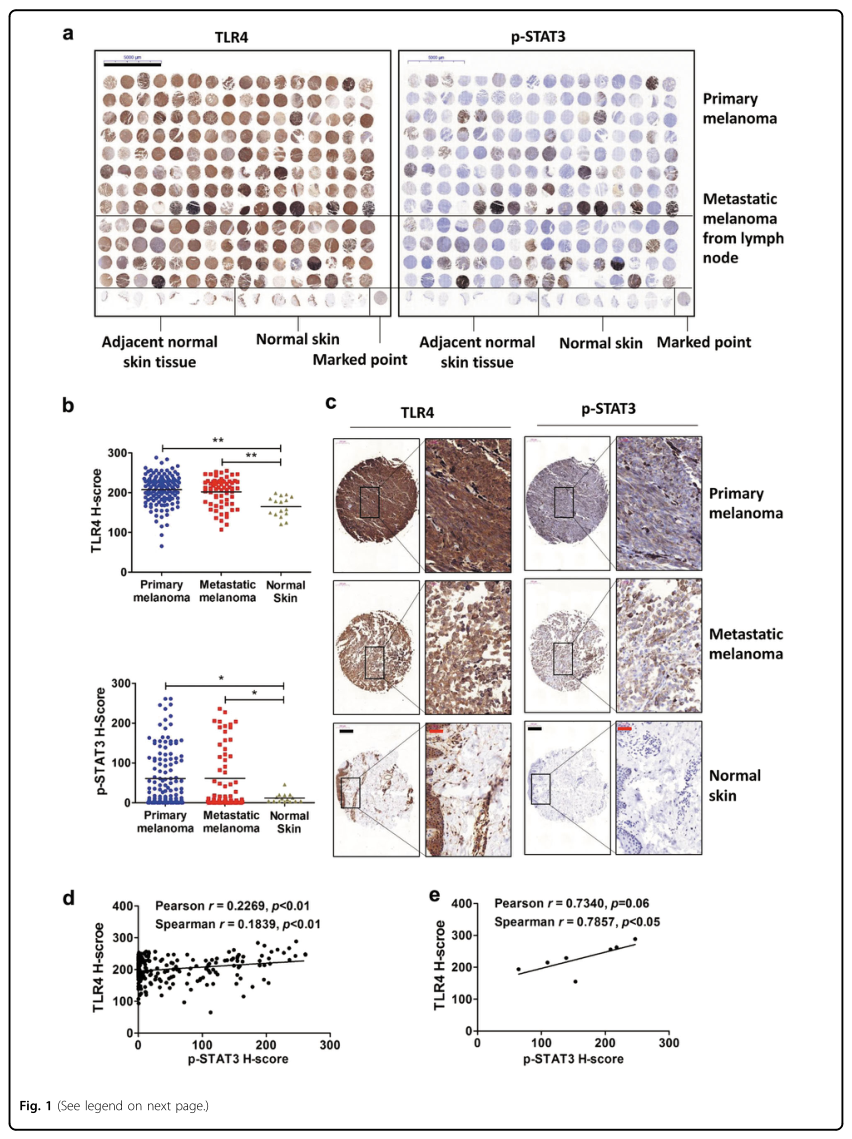
图1
2. TLR4配体通过MYD88和TRIF在黑素瘤细胞中激活STAT3
为了确定TLR4信号是否涉及黑色素瘤细胞中的STAT3活化,研究者使用TLR4配体刺激黑色素瘤细胞,并检测STAT3的磷酸化和核定位。结果表明,两种TLR4配体LPS和MPLA均能增加多种黑色素瘤细胞系中STAT3的磷酸化水平(图2A)。一旦STAT3被磷酸化,它就移位到细胞核中,在那里它起到转录因子的作用。研究者还发现,LPS增加了STAT3在A375细胞中的核定位(图2B),进一步证实了TLR4配体刺激对STAT3的激活。TLR4和TLR2广泛表达于黑色素瘤细胞,为了确定TLR4对LPS和MPLA诱导的STAT3激活的必要性,研究者用一种特定的siRNA敲除了A375细胞中的TLR4,结果显示,LPS和MPLA显著增加了转染阴性对照(NC)siRNA的A375细胞中STAT3的磷酸化(图2C,D)。TLR4基因敲除可完全阻断LPS和MPLA促进的STAT3磷酸化。这些数据证实了LPS和MPLA诱导的STAT3在黑色素瘤中是通过TLR4激活的。
在配体识别时,TLR4信号通过MYD88依赖或TRIF依赖的方式。研究者发现,沉默MYD88或TRIF,就像沉默TLR4一样,同时取消了LPS和MPLA增强的STAT3磷酸化(图2C,D)。敲除实验结果表明MYD88和TRIF都参与了TLR4配体介导的STAT3的激活,此外,TLR4基因的敲除降低了黑色素瘤细胞中STAT3的蛋白水平,但不降低其mRNA水平(图2C,E)。MyD88或TRIF基因敲除不影响总STAT3蛋白水平(图2C,E)。这些观察表明,TLR4信号使用不同的机制来激活STAT3和维持STAT3蛋白的稳定性。
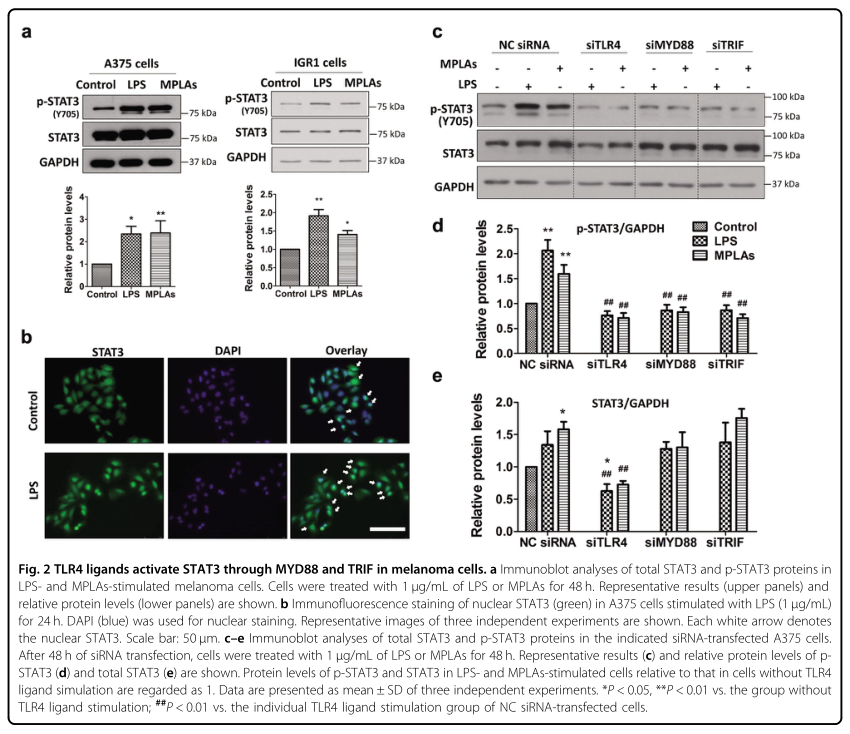
图2
3. TLR4配体促进STAT3介导的细胞事件在黑色素瘤进展中的作用
已经观察到TLR4配体增加了STAT3在黑色素瘤细胞中的核定位(图2B)。RT-qPCR结果显示,LPS或MPLA刺激黑色素瘤细胞后,BCL2L1和MCL1、参与黑色素瘤转移和血管生成的MMP-2、MMP-9和VEG的mRNA水平均升高(图3A)。接下来,研究者在细胞模型中研究了TLR4配体是否触发了上述基因相关的恶性行为。结果表明,MPLA和LPS以相似的方式促进黑色素瘤细胞的增殖(图3B)和侵袭(图3C)。为了检测黑色素瘤细胞中TLR4信号是否促进血管生成,用MPLA和LPS刺激的A375细胞的条件培养液分别孵育HUVEC,并计数形成的管数。结果显示,两种条件培养液均能促进人脐静脉内皮细胞(图3D)的管状形成,表明TLR4信号通路促进了体外血管生成。
MPLA已被临床测试为治疗包括黑色素瘤在内的癌症的免疫治疗剂。研究者发现MPLA能激活黑色素瘤细胞中的STAT3。为了检验MPLA是否刺激免疫抑制细胞因子的产生,研究者收集了MPLA处理的A375细胞的条件培养液,并进行了细胞因子阵列检测。结果显示,刺激MPLA后,ICAM121、IL-622、CXCL1222、G-CSF23和PAI-124等免疫抑制细胞因子均增加(图3E,F)。G-CSF可以被TLR4信号上调,并且能够激活黑色素瘤中的STAT3。ICAM-1、IL-6、CXCL12和PAI1受STAT3转录调控。ICAM-1在改变的蛋白中增加最多。使用酶联免疫吸附试验(ELISA)对其进行了定量。结果证实,MPLA能显著增加ICAM-1的分泌,LPS也能增加ICAM-1的分泌(图3G)。这些结果表明黑色素瘤细胞中的TLR4信号增加了免疫抑制细胞因子的分泌,这种细胞因子可以被STAT3上调。
接下来,研究者研究了TLR4信号介导的黑色素瘤进展中的细胞事件是否需要STAT3的激活。为此,研究者建立了一对稳定的细胞株B16STAT3β(高表达STAT3β的细胞)和B16NC(含有空载体的阴性对照细胞株)。WB结果显示,B16STAT3β细胞中针对Bclxl、Mcl-1、VEGF和MMP2的STAT3蛋白水平均低于B16NC细胞(图3H),表明STAT3β可阻断STAT3的激活。细胞功能实验结果表明,脂多糖和MPLA均能显著促进B16NC细胞的增殖(图3I)和侵袭(图3J),但对B16STAT3β细胞无明显影响,提示STAT3的激活在β信号诱导的黑色素瘤进展中起关键作用。
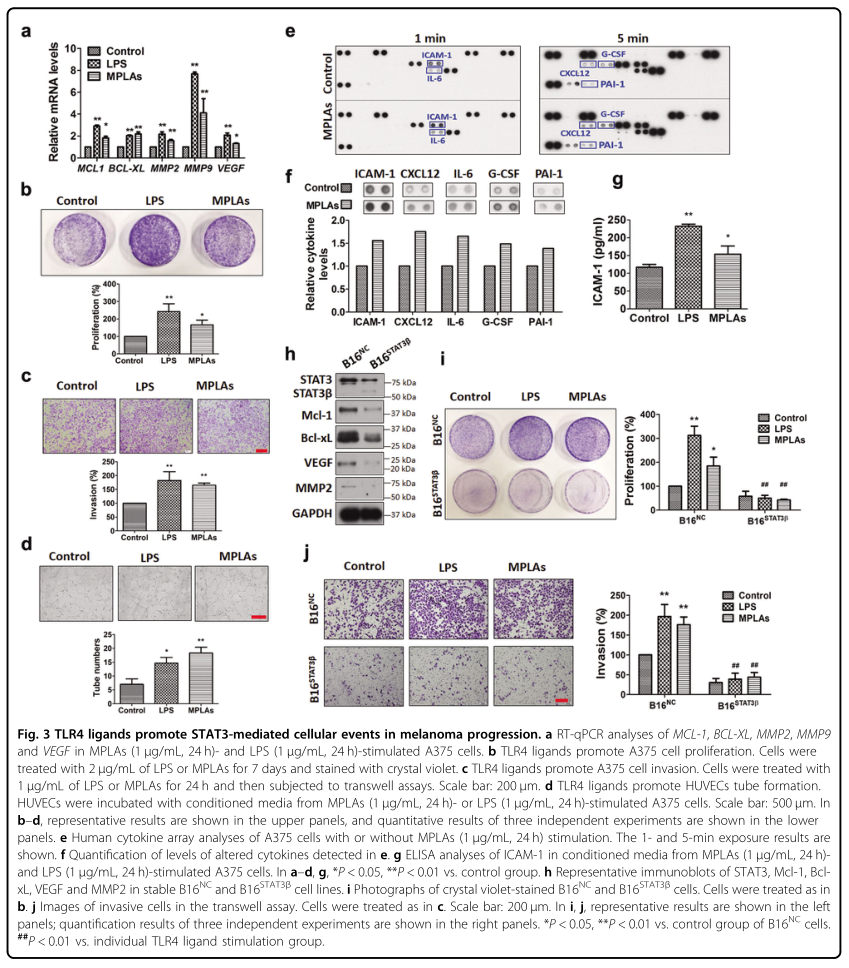
图3
4. 组成性TLR4信号增强STAT3激活促进小鼠黑色素瘤进展
为了确定体内黑色素瘤中TLR4和STAT3之间的关系,研究者建立了一对稳定的细胞系A375CA-TLR4(含有TLR4的组成型活性变体)和A375NC(含有空载体的阴性对照细胞系),然后比较两种细胞系中的STAT3活性,并进一步比较了A375CA-TLR4和A375NC荷瘤小鼠的肿瘤生长、血管生成和EMT。结果显示A375CA-TLR4细胞中磷酸化STAT3的蛋白质水平和STAT3的转录活性高于A375NC细胞(图4A,B),表明TLR4的组成型活化增强了黑素瘤细胞中的STAT3活化。EMT是肿瘤细胞侵袭和转移的早期事件,在A375CA-TLR4细胞中观察到了EMT样形态学特征,例如失去细胞间相互作用和纺锤形表型(图4C),表明TLR4活化促进黑素瘤中的EMT过程。
在A375CA-TLR4和A375NC异种移植小鼠模型中,A375CA-TLR4异种移植瘤的重量比A375NC组重(图4D)。在A375CA-TLR4肿瘤中,总的和磷酸化的STAT3蛋白水平均上调(图4E)。肿瘤组织免疫组化染色显示,A375CA-TLR4肿瘤与A375NC肿瘤相比,Ki-67(细胞增殖标记物)、CD31(血管生成标记物)、N-cadherin(两种间质标记物)和vientin(波形蛋白)蛋白水平均有升高,E-cadherin(上皮性标记物)水平降低(图4F)。这些数据表明,TLR4的激活增强了黑色素瘤组织中STAT3的激活,并促进了小鼠肿瘤的生长、血管生成和EMT。
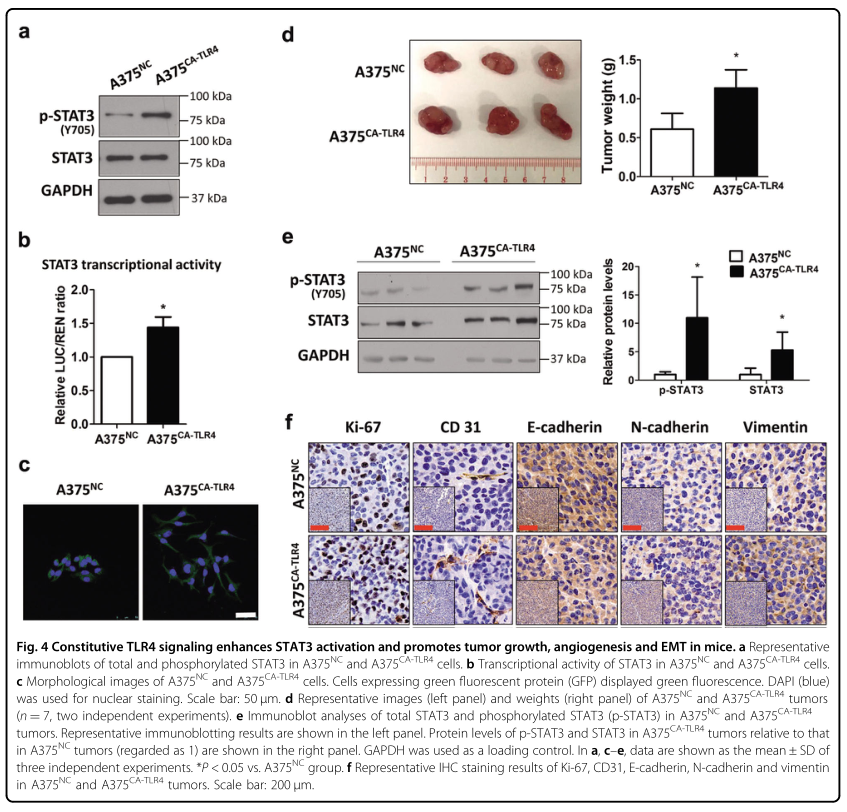
图4
5. TLR4信号介导的小鼠黑色素瘤进展需要STAT3的激活
接下来,研究者在存在或不存在LPS的情况下分别将悬浮在PBS中的B16NC和B16STAT3β细胞皮下注射到小鼠体内。肿瘤称重显示,B16STAT3β肿瘤比B16NC肿瘤更小更轻(图5A)。此外,LPS促进B16NC肿瘤中的肿瘤生长(图5A)和STAT3活化(图5B),但对B16STAT3β肿瘤的影响较小,表明STAT3活化在TLR4信号传导介导的黑素瘤生长中起积极作用。肿瘤组织的IHC染色显示,与没有LPS刺激的B16NC肿瘤相比,LPS刺激的B16NC肿瘤中Ki-67,CD31,N-钙粘蛋白和波形蛋白的表达水平增加,而E-钙粘蛋白的表达降低(图5C)。IHC染色结果揭示了STAT3活化在TLR4信号传导介导的黑素瘤生长、血管生成和EMT中的重要作用。
流式细胞分析结果显示,LPS刺激增加了B16NC荷瘤小鼠脾髓系来源的抑制细胞(MDSC;CD11b+Gr-1+细胞)的百分比,但对B16STAT3β荷瘤小鼠无明显影响(图5D)。MDSC负责免疫抑制,从而限制CD8T细胞的活性和肿瘤浸润。在LPS刺激下,B16NC荷瘤小鼠脾脏和肿瘤浸润性CD8(CD3+CD8+)T细胞的百分比显著降低(图5D)。在B16STAT3β荷瘤小鼠中,LPS对脾脏CD8 T细胞数量的降低作用弱于B16NC荷瘤小鼠(图5D),提示STAT3激活在LPS诱导的脾脏CD8 T细胞减少中起作用。流式细胞分析还显示,LPS刺激的B16NC肿瘤中NK细胞的数量明显减少,而没有LPS刺激的B16NC肿瘤中则没有(图5D)。通过在肿瘤中表达STAT3β来阻断STAT3的激活,可增加肿瘤浸润的NK细胞,并减弱LPS诱导的NK细胞减少(图5D)。这些变化提示,在黑色素瘤微环境中,STAT3的激活参与了TLR4信号介导的免疫抑制。
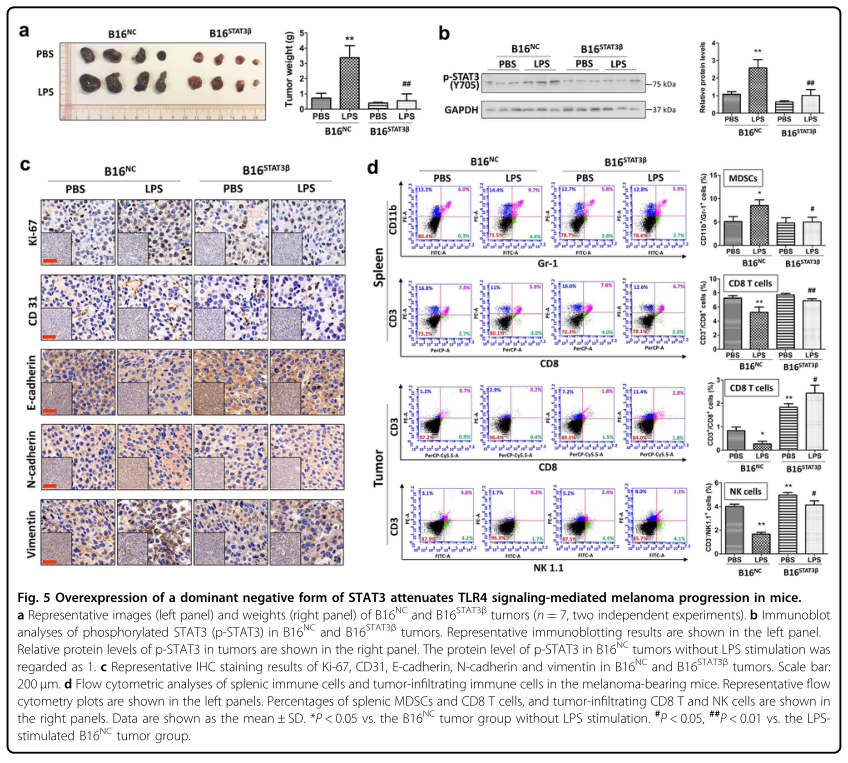
图5
6. 药物抑制TLR4/STAT3通路可抑制黑色素瘤细胞的体内外增殖
接下来,研究者使用了在多种癌细胞中抑制TLR4和STAT3通路的天然倍半萜内酯——小白菊内酯,以及TLR4拮抗剂TAK-242,来检测抑制TLR4/STAT3通路是否会抑制黑色素瘤细胞的增殖。结果显示,小白菊内酯和TAK-242均呈剂量依赖性地降低A375和B16黑色素瘤细胞的TLR4、STAT3和磷酸化STAT3的蛋白水平,并抑制其增殖(图6B)。体内实验结果表明,小白菊内酯呈剂量依赖性地降低肿瘤重量和肿瘤体积,而不影响小鼠的体重。WB结果显示,小白菊内酯显著降低B16肿瘤中TLR4、STAT3和磷酸化STAT3的蛋白水平(图6F)。这些结果均表明,抑制TLR4/STAT3通路是治疗黑色素瘤的可行策略。
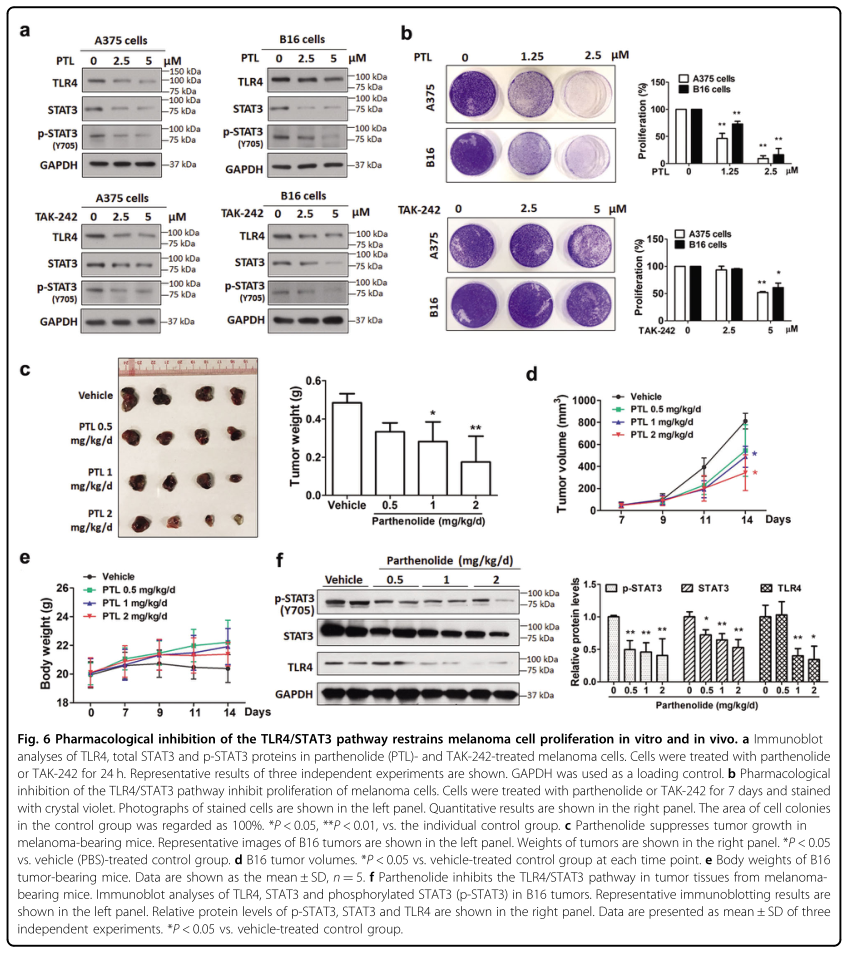
图6









 实验热线:4006991663
实验热线:4006991663








