免疫共沉淀(Co-IP)是蛋白质相互作用研究的常用技术,原理是借助磁珠或琼脂糖珠偶联抗体,捕获目标蛋白及其互作蛋白。
高分文献的Co-IP研究核心在于实验设计:如何验证互作特异性?怎样通过分组对照揭示调控机制?复合物解析、修饰调控等不同研究目的,对应何种设计逻辑?
辉骏生物在本文深入解析Co-IP的底层设计思路,助你掌握符合高分研究范式的实验设计与解读能力,提升课题说服力与发表层次。
Co-IP 4大核心应用(覆盖基础验证至高级筛选):
1. 验证已知蛋白互作
2. 质谱筛选未知互作蛋白(含下游蛋白、药物靶点)
3. 解析多蛋白复合物组成
4. 探究翻译后修饰对蛋白互作的调控
Co-IP操作流程
看CoIP实验文献时,你是否仍被复杂实验设计绕晕:如何验证互作特异性?外源因素对蛋白结合力的影响怎么设计实验?多蛋白互作、结合结构域如何定位?甲基化 / 泛素化等修饰对互作的调控怎么验证?
别急!Co-IP 文献解读进阶篇来袭,辉骏生物在本文拆解高分文章经典实验设计逻辑,轻松拿捏文献解读与实验方案设计!
Co-IP解读案例1
前期已证实PRMT1与FBXO7存在互作,本实验核心亮点在于敲除细胞系+正反拉蛋白的进阶设计:跳出单纯的存在性验证,直击二者结合量的量化分析,让结论更严谨有力。
shPRMT1后条带变浅,表明结合量下降,验证互作阳性;正反拉蛋白即分别以PRMT1、FBXO7为诱饵,捕获对应互作蛋白。
这种组合设计是高分文献验证蛋白互作的经典范式,既能排除非特异性结合干扰,又能量化互作强度,值得直接借鉴。

图1 Co-IP验证PRMT1蛋白和FBXO7蛋白之间的结合量分析
想验证1个诱饵蛋白与2个同标签候选蛋白的互作?这组Co-IP实验设计可直接抄作业!
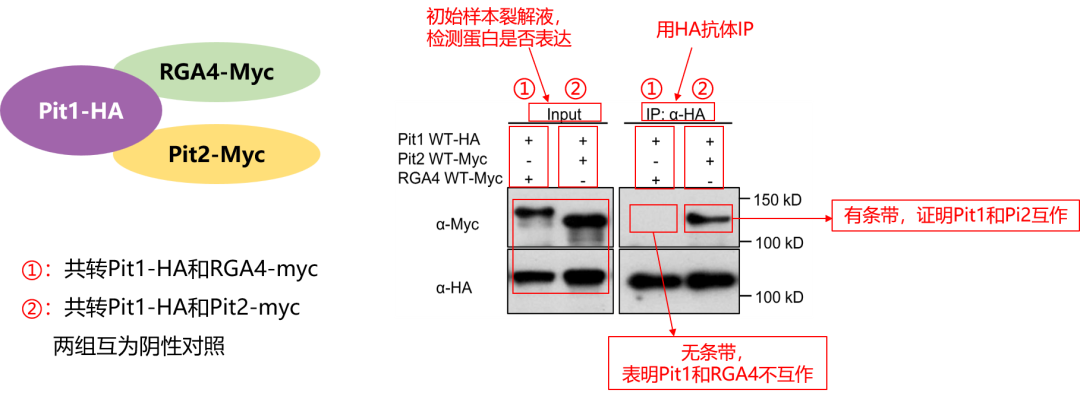
核心分组:①共转Pit1-HA与RGA4-myc质粒;②共转Pit1-HA与Pit2-myc质粒。
设计亮点:Input验证互为阴性对照——Input条带清晰,证明3种目的蛋白均成功表达;且转染RGA4-myc组无Pit2-myc条带,转染Pit2-myc组无RGA4-myc条带,排除非特异性干扰。
IP结果解读:HA抗体下拉Pit1-HA时,仅②组富集到Pit2-myc,①组无RGA4-myc条带,直接证实Pit1与Pit2特异性互作、与RGA4无互作。
“1诱饵+多候选+阴性对照内置”的设计,高效解决同标签候选蛋白互作验证难题,科研人直接照搬提效!
图2 Co-IP验证Pit1-HA与RGA4-myc、Pit2-myc互作蛋白之间的相互作用
Co-IP解读案例3
Co-IP机制研究神设计!探究外源因素对蛋白结合力的影响,直接抄文献方案!想明确蛋白、药物等外源因素对蛋白互作的调控作用?这套高分文献同款设计轻松搞定!
实验分组(4对照+2实验):
对照组:①空白组 ②仅转Flag-MVP ③仅转HA-ASK1(诱饵) ④仅转His-TRAF6(互作蛋白)
实验组:⑤共转HA-ASK1+His-TRAF6(验证基础互作) ⑥共转Flag-MVP+HA-ASK1+His-TRAF6(探究MVP调控作用)
关键前提:Input验证所有目的蛋白均成功表达。
结果解读:HA抗体下拉HA-ASK1后,⑤组检测到His-TRAF6(证实基础互作);⑥组His-TRAF6条带消失,证明过表达MVP显著抑制二者结合。
“多对照+基础互作+调控组”三层设计,精准排除假阳性、锁定调控效应,是蛋白互作机制研究的经典范式,科研人直接照搬让实验更严谨!
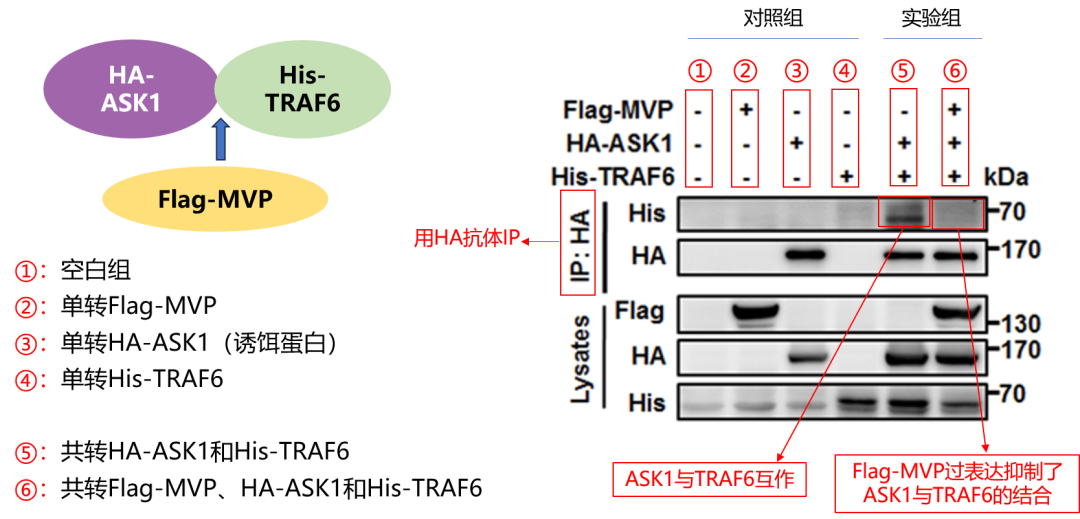
图3 Co-IP验证Flag-MVP蛋白对HA-ASK1和His-TRAF6蛋白结合力的的影响
Co-IP解读案例4
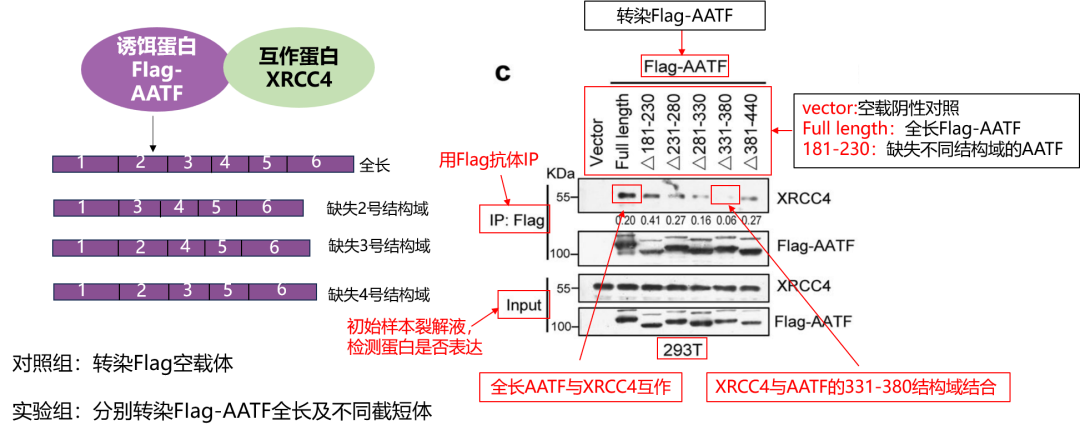
Co-IP 定位蛋白结合结构域!文献高频截短体策略,精准锁定互作关键区域!想明确蛋白互作的核心结构域?这套高分方案直接用!
实验设计:诱饵蛋白 Flag-AATF(含全长 + 不同截短体),互作蛋白 XRCC4;对照组转染 Flag 空载体,排除标签干扰。
关键前提:Input 验证证实 AATF 全长、各截短体及 XRCC4 均成功表达,排除假阴性。
结果解读:Flag 抗体下拉后,全长组可检测到 XRCC4 条带;缺失 331-380 氨基酸的截短体组无条带,直接锁定AATF 的 331-380 结构域是二者互作关键靶点。
“全长 + 截短体”Co-IP 设计,是蛋白结合结构域定位的金标准,助力机制研究更深入!
图4 Co-IP验证FIag-AATF蛋白与XRCC4蛋白结合的结构域
Co-IP解读案例5
Co-IP解锁甲基化调控!**敲除细胞系+IP验证**,精准揭示蛋白修饰机制!想探究蛋白对目标蛋白甲基化的调控作用?这套高分方案直接抄!
实验设计:在Huh7、PLC/PRF/5细胞中,构建FBXO7敲除组(shFBXO7)与对照組(shScramble,无靶向性),通过敲除后对比探究FBXO7对PHGDH甲基化的影响。
关键验证:WCL检测证实目的蛋白均表达,IB显示shFBXO7组FBXO7条带显著减弱,敲除细胞系构建成功。
结果解读:PHGDH抗体下拉后,甲基化位点特异性抗体检测显示—shFBXO7组PHGDH甲基化条带更深,且PHGDH本底表达无变化,证明FBXO7敲除不影响其合成,仅特异性促进甲基化。
结论:FBXO7负向调控PHGDH甲基化!“敲除细胞系+Co-IP+修饰位点检测”组合设计,排除干扰、精准量化,助力机制研究更具说服力~
图5 Co-IP验证shFBXO7对PHGDH甲基化的修饰作用
Co-IP解读案例6
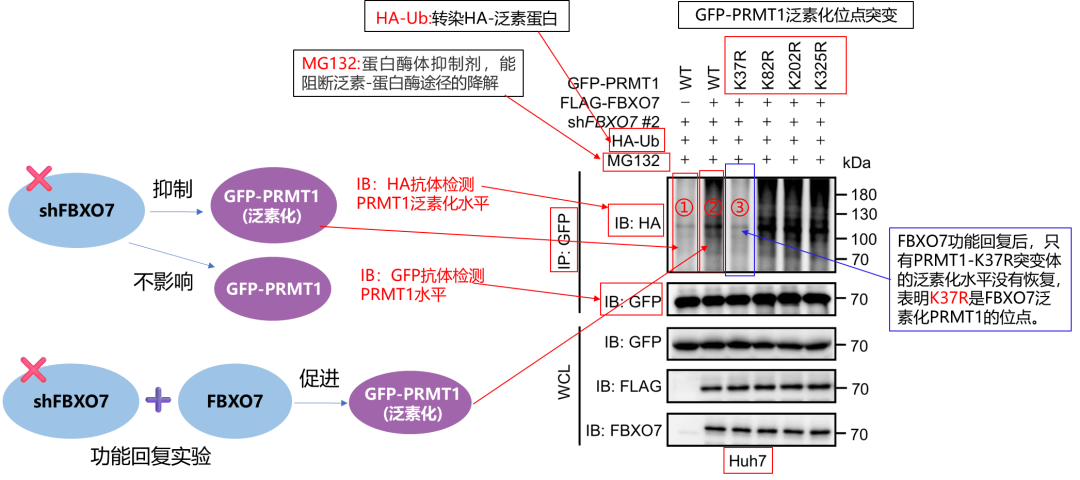
Co-IP解析泛素化机制!**突变体+回复实验**,精准锁定泛素化关键位点!想探究蛋白泛素化调控机制与关键修饰位点?这套教科书级设计直接抄!
核心要素:KR(GFP-PRMT1泛素化位点突变体)、HA-Ub(泛素标签)、MG132(阻断泛素降解);IP下拉GFP-PRMT1,IB检测泛素化水平与蛋白本底。
结果解读:① shFOBX7组HA-Ub条带变浅、GFP条带不变,证明敲除FOBX7特异性抑制PRMT1泛素化;② 回补Flag-FOXB7后泛素化恢复,反向验证FOBX7是正向调控因子;③ K37R突变体无法恢复泛素化,锁定K37是PRMT1泛素化核心靶点。
“抑制+回复+突变体筛选”三重验证,明确调控关系、定位关键位点,让实验逻辑拉满!
图6 Co-IP验证shFBXO7对PHGDH甲基化的修饰作用
IP/Co-IP实验设计有疑问?欢迎咨询辉骏生物技术人员!辉骏生物提供全面的蛋白互作实验服务,涵盖了Co-IP、RIP、RNA pull down、ChIP、DNA pull down等多个领域。这些实验服务能够满足不同科研人员的需求,无论是基础研究还是临床应用研究,都能在这里找到合适的解决方案。
此外,辉骏生物为蛋白互作实验服务配套了各类专用试剂盒。试剂盒经过我们精心研发和优化,具有高灵敏度、高特异性和良好的重复性等特点。不同的试剂盒适用于不同的实验类型和样本类型,为您的实验提供有力的支持。辉骏生物各类互作试剂盒能够在保证实验效果的前提下,最大程度地减少样本的使用量,避免样本的浪费。
CoIP实验参考文献
[1] Mi L, Cai Y, Qi J, et al. Elevated nonhomologous end-joining by AATF enables efficient DNA damage repair and therapeutic resistance in glioblastoma. Nat Commun. 2025;16(1):4941.
[2]Liu, Qingling., Pan, Junlu., Bao, Linrui., Xu, Chunxiang., Qi, Yu.. Major Vault Protein Prevents Atherosclerotic Plaque Destabilization by Suppressing Macrophage ASK1-JNK Signaling. Arteriosclerosis, thrombosis, and vascular biology, 2022, 42(5):580-596.
[3]Luo L, Wu X, Fan J, et al. FBXO7 ubiquitinates PRMT1 to suppress serine synthesis and tumor growth in hepatocellular carcinoma. Nat Commun. 2024;15(1):4790. Published 2024 Jun 5.
[4]Li Y, Wang Q, Jia H, et al. An NLR paralog Pit2 generated from tandem duplication of Pit1 fine-tunes Pit1 localization and function. Nat Commun. 2024;15(1):4610. Published 2024 May 30.
[5]Liu Q, Pan J, Bao L, et al. Major Vault Protein Prevents Atherosclerotic Plaque Destabilization by Suppressing Macrophage ASK1-JNK Signaling. Arterioscler Thromb Vasc Biol. 2022;42(5):580-596.










 实验热线:4006991663
实验热线:4006991663