
内容概述:
2022年3月,辉骏生物的合作伙伴——中山大学中山眼科中心团队在期刊Advanced Science(IF2020=16.806)上发表题为“MYPT1/PP1-Mediated EZH2 Dephosphorylation at S21 Promotes Epithelial-Mesenchymal Transition in Fibrosis through Control of Multiple Families of Genes “的文章。实验发现甲基转移酶EZH2在晶状体中高表达,AKT-EZH22通路在TGF-β诱导的上皮-间质转化(EMT)中非常重要。质谱分析结果显示,MYPT1/PP1能使EZH2-S21去磷酸化。这些结果确定了EZH2-S21的特异性磷酸酶,并揭示了EZH22去磷酸化控制的、与晶状体EMT和眼睛前囊下白内障(ASC)发病相关的几个基因家族。
主要技术:
shRNA慢病毒稳转株构建、免疫共沉淀(Co-IP)、蛋白质谱检测(LC-MS/MS)、CRISPR/Cas9;
辉骏生物为本研究提供了蛋白质谱检测和分析服务(LC-MS/MS)。
研究背景:
EZH2是多梳抑制复合物2(PRC2)中发挥甲基转移酶活性的核心成员,可以催化H3K27Me3,进而抑制下游基因转录。此外,EZH2还可以作为独立于PRC2复合物的非组蛋白甲基转移酶,甲基化转录因子和其他靶标。蛋白磷酸化在EZH2功能开关中起着重要作用。已知AKT激酶可以介导EZH2-S21磷酸化来抑制其H3K27Me3催化功能。然而,负责EZH2-S21去磷酸化的酶仍然未知。
研究路线:
WB和IF检测发现AGS小鼠模型和患者中的EZH2-S21磷酸化与EMT有关生长RNA干扰实验确定AKT磷酸化EZH2-S21来介导TGF-β诱导的晶状体上皮细胞EMTCo-IP MS和敲除实验发现并证实MYPT1-PP1使EZH2-S21去磷酸化来抑制EMTEZH2-S21突变表达、转录组分析和ChIP-seq确认EZH2-S21去磷酸化调控的下游基因RNA干扰和基因敲除实验证实EZH2-S21去磷酸化通过POSTN基因促进EMT和ASC细胞、小鼠模型和患者检测证实EZH2-S21磷酸化状态调控了EMT相关基因表达和AGS病变
研究结果:
1. EZH2在晶状体上皮细胞中高表达且其活性和S21磷酸化水平随EMT而增强
为了解EZH2在晶状体中的作用,Western blot(WB)检测了3周龄和成年小鼠晶状体上皮细胞和纤维细胞中的EZH2和EZH2-S21磷酸化(p-EZH2 S21)水平,结果显示:EZH2在3周龄和成年上皮细胞中均高表达,p-EZH2 S21在成年上皮细胞中的水平显著高于3周龄小鼠,EZH2和p-EZH2 S21在成年纤维细胞中几乎检测不到(图1A,B)。
正因为EZH2在小鼠晶状体中高表达,因此推测其可能参与ASC上皮细胞的EMT进程。对患者和小鼠模型的ASC斑块进行IF和WB分析,发现AKT活性和p-EZH2 S21水平显著高于对照(图1C-E)。低活性的EZH2(表现为较高的p-EZH2-S21和较低的H3K27me3)伴随着为高水平的EMT标记物(FN和α-SMA)(图1E)。
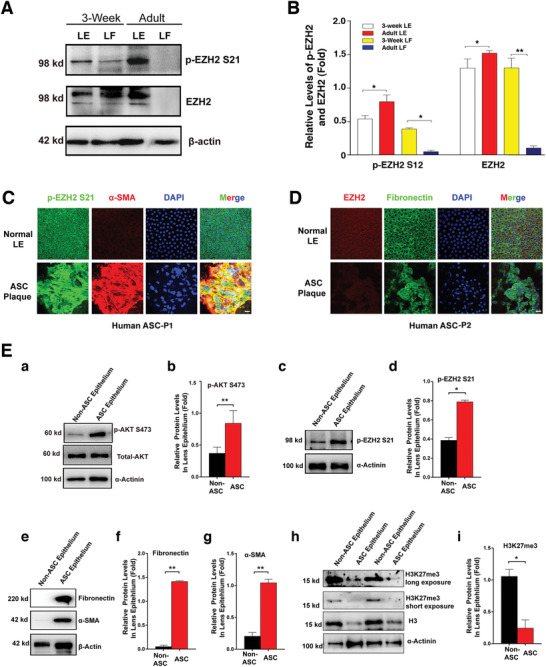
图1
2. TGF-β激活AKT-EZH2-H3K27Me3通路来介导晶状体上皮细胞中的EMT
为了确定AKT是否也能磷酸化EZH2-S21来调节晶状体细胞的EMT,作者首先用TGF-β处理人晶状体上皮细胞系HLE 48小时,建立了EMT模型,接着用AKT活性抑制剂来封闭AKT的活性,这使得p-EZH2 S21减弱,H3K27Me3增强,并且消除了TGF-β诱导引起的EMT标记物FN1和α-SMA的水平增加;AKT1和AKT2的敲低也得到了类似结果(图2A-G)。这表明AKT能调控EZH2-S21磷酸化,介导TGF-β诱导的晶状体上皮细胞EMT。
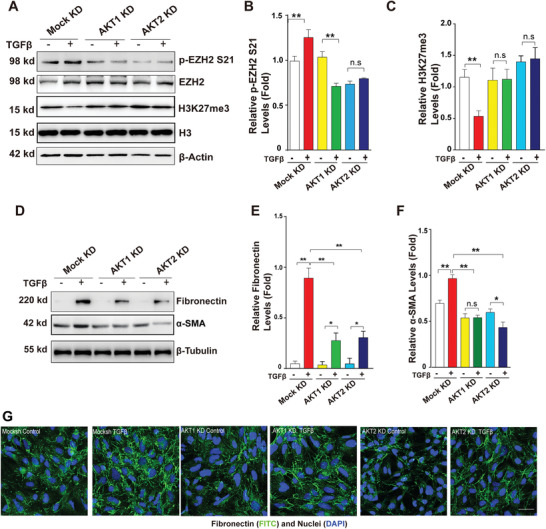
图2
3. MYPT1-PP1使EZH2-S21去磷酸化
那么是哪个蛋白酶去磷酸化EZH2-S21呢?作者利用OA(PP1和PP2A的有效抑制剂)处理HLE细胞,发现OA剂量依赖性的增加了p-EZH2 S21水平(图3A-B)。免疫共沉淀质谱(Co-IP MS)分析发现EZH2的结合蛋白除了有PRC2的其他组分SUZ12、EED和RBBP4之外,还有PP1调节亚基PPP1R12A(也称为MYPT1),这引起了作者的注意。Co-IP WB和IF实验进一步确定了EZH2和MYPT1间的相互作用(图3C-F)。
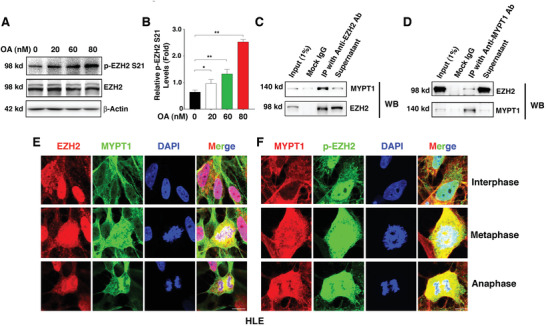
图3
4. MYPT1敲除增强了晶状体上皮细胞EMT
为了证实MYPT1-PP1通过去磷酸化EZH2影响晶状体上皮细胞的EMT进程,作者采用CRISPR/Cas9技术敲除HLE细胞中的MYPT2,发现p-EZH2 S21增强,H3K27Me3水平下降(图4A-C),并且TGF-β诱导的EMT显著增强(图4D-G)。MYPT2和EZH2沉默的斑马鱼突变体也表现出严重的心脏水肿、脊柱弯曲和小眼等表型,眼部组织中的EMT标志物(FN1a, LAMC2和MMP9)也显著上调。这些结果表明,MYPT1-PP1可以使EZH2去磷酸化,激活其甲基转移酶活性,并在体外和体内调节EMT。
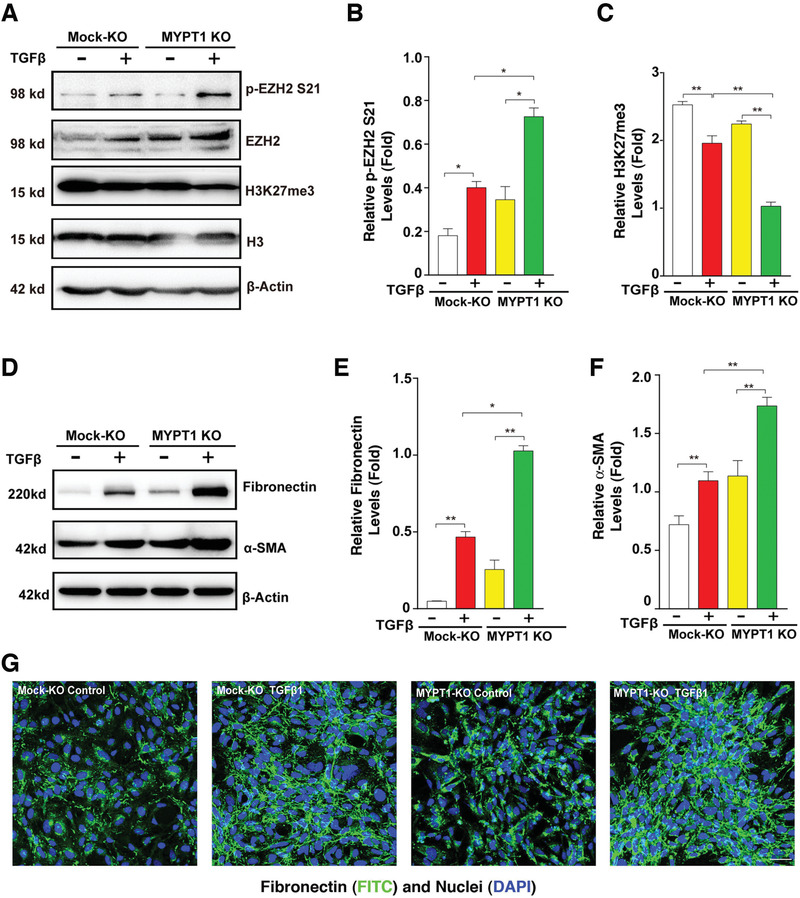
图4
5. 内源性EZH2-S21突变抑制了TGF-β诱导的EMT
为了进一步确定EZH2-S21磷酸化能否从功能上控制EMT进程,作者采用EZH2野生型和EZH2-S21突变型(丝氨酸突变成赖氨酸)慢病毒分别感染HLE细胞构建稳转细胞株(图5A-C),WB和IF分析证实,相比于空载对照,它们的表达均显著抑制了TGF-β诱导的EMT标志物上调(图5D-G)。
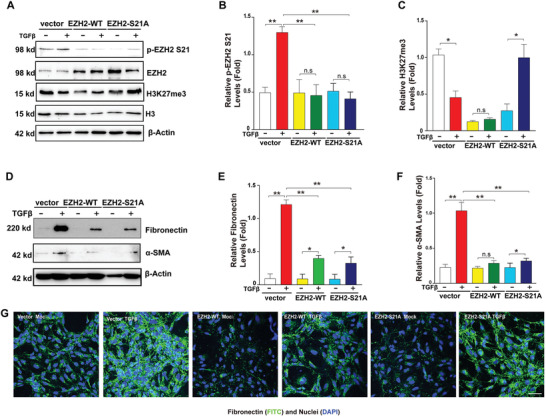
图5
6. EZH2去磷酸化调控多个EMT相关的基因家族
为了找到EZH2去磷酸化调控的下游基因,作者对EZH2野生型、EZH2-S21突变型和空载对照细胞株进行了转录组分析, GO分析结果显示很多差异基因属于细胞外基质基因和细胞粘附基因;之后又在敲除了内源EZH2的细胞中再表达EZH2野生和EZH2-S21突变体,并用TGF-β处理。qPCR检测了转录组筛选出的差异基因,确定了三个参与EMT调控的基因家族——胶原基因、细胞外基质基因和细胞粘附基因(图6A-D)。为了进一步证实EZH2去磷酸化调控了这3个基因家族,选取了3个主要靶基因Col1A1、MMP17和POSTN进行ChIP-seq,发现TGF-β处理的HLE细胞中的H3K27me3水平远小于未处理组(图6E)。
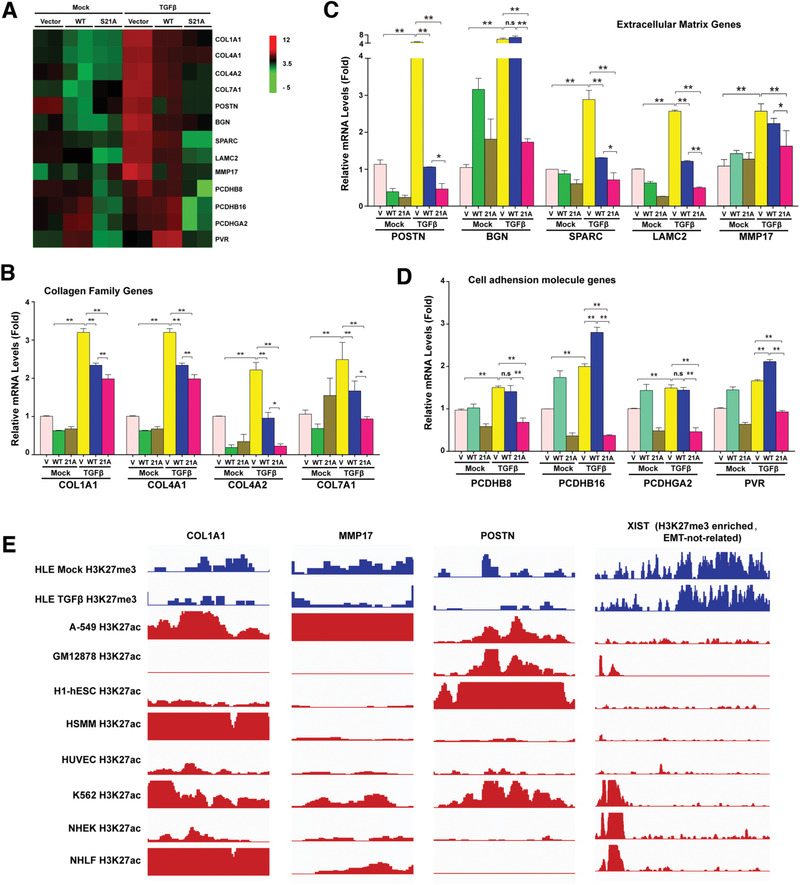
图6
7. EZH2-S21磷酸化调控POSTN基因来促进TGF-β诱导的EMT和ASC
为了进一步确定上述EMT相关基因家族确实受EZH2-S21去磷酸化控制并参与EMT和AGS病变,研究者利用慢病毒构建EZH2沉默的HLE细胞系,再此基础上分别进行EZH2过表达、EZH2-S21A过表达和EZS2-S21D过表达(图7A-C)。qPCR检测发现POSTN在EZS2-S21D细胞中的丰度最高(图7D)。使用CRISPR/Cas9技术(图7E)或shRNA(图7F)敲除MYPT1可显著增加POSTN mRNA水平,在MYPT1突变的斑马鱼眼睛中也观察到POSTN的表达增强。
在POSTN沉默细胞中,TGF-β处理组的EMT标记物(FN、COL1A1、SNAI1和SNAI2)水平均显著低于非沉默细胞(图7G-J)。在POSTN基因敲除小鼠中,ASC的诱导受到限制,EMT标志物(FN、COL1A1)的表达也显著降低(图7K-M)。在患者ASC斑块中,POSTN也高表达(图7N)。
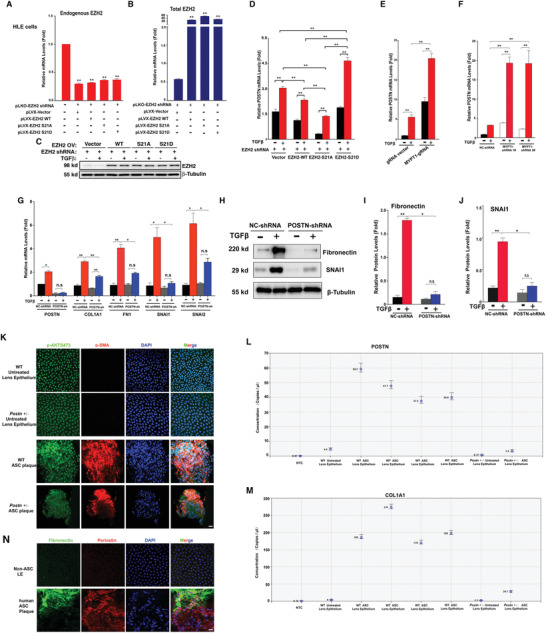
图7
8. MYPT敲除促进了EMT相关基因表达和AGS病变
为了进一步确定EZH2-S21去磷酸化直接控制的EMT相关基因,研究者用TGF-β处理MYPT敲除细胞或未敲除细胞,qPCR方法检测发现SPARC、BGN、PCDHB8、PCDHB16、COL1A1、COL4A1、COL4B2和COL7A1的水平显著高于对照(图8A)。在ASC小鼠模型(图8B)和人类ASC患者(图8C)中也得到了相似结果,表明这些由EZH2-S21去磷酸化控制的EMT相关基因显著促进了ASC病变。
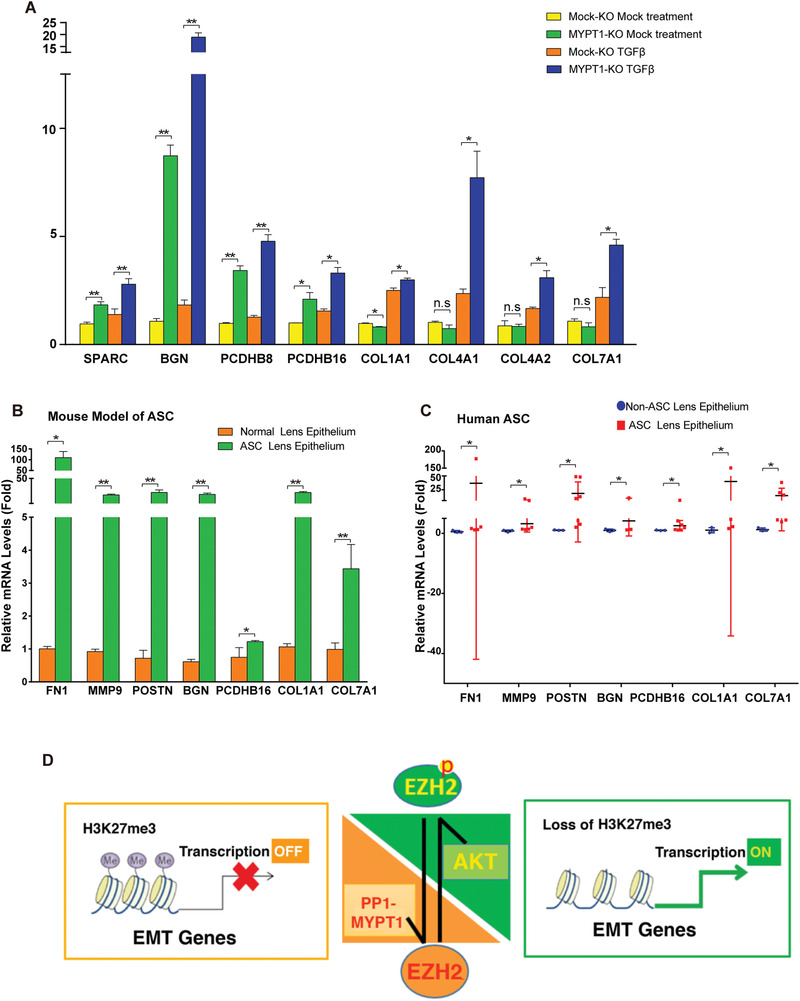
图8
研究结论:
该研究不仅确定了AKT激活EZH2-H3K27Me3来调控TGF-β诱导的晶状体上皮细胞EMT,而且发现了MYPT1-PP1可使EZH2-S21去磷酸化,进而调控3个EMT相关基因家族参与ASC病变(图8D)。









 实验热线:4006991663
实验热线:4006991663











