神经元是神经系统的解剖和功能单位,调节生命功能和高级功能。 在体内极少数不再生的细胞中,尽管它们的完整性受到了许多威胁,但这些细胞必须保持健康,同时仍能正常运作。 杂志上的一篇新研究论文 EMBO Reports 描述了 DNA 损伤如何影响神经健康和功能。
介绍
神经元具有高效的机制来抵抗基本遗传密码的变化,称为 DNA 损伤反应 (DDR) 途径。 如果在这些途径中发生功能丧失突变,它们遭受的损失最大,因为它们执行的许多任务除了需要转录准确性外,还消耗大量能量。
如果这些通路在需要时无法发挥作用,有害的基因组重排、转录通路的失调和受损基因组位点的积累会导致对神经元的毒性累积。 最终,这些导致细胞凋亡、衰老或不受调节的细胞分裂、衰老和退化的迹象。
神经退行性疾病是无法存活的神经元的结果,从长远来看,这反过来会导致记忆力减退、运动障碍和独立性丧失。 与神经退行性变相关的疾病在美国的死亡原因中排名第三,在世界范围内排名第五。
最近的研究表明,大量的 DDR 通路在防止基因组 DNA
因外部损伤和体内毒性过程造成的损伤方面发挥着重要作用。
每条通路都会对特定类型的损伤做出反应,使用自己的级联酶和修复蛋白首先检测损伤,然后通过核酸酶活性修复或切除受损位点,最后构建新的 DNA
以填补缺口聚合酶的帮助。 然后使用连接酶将 DNA 链的切割末端密封在一起。
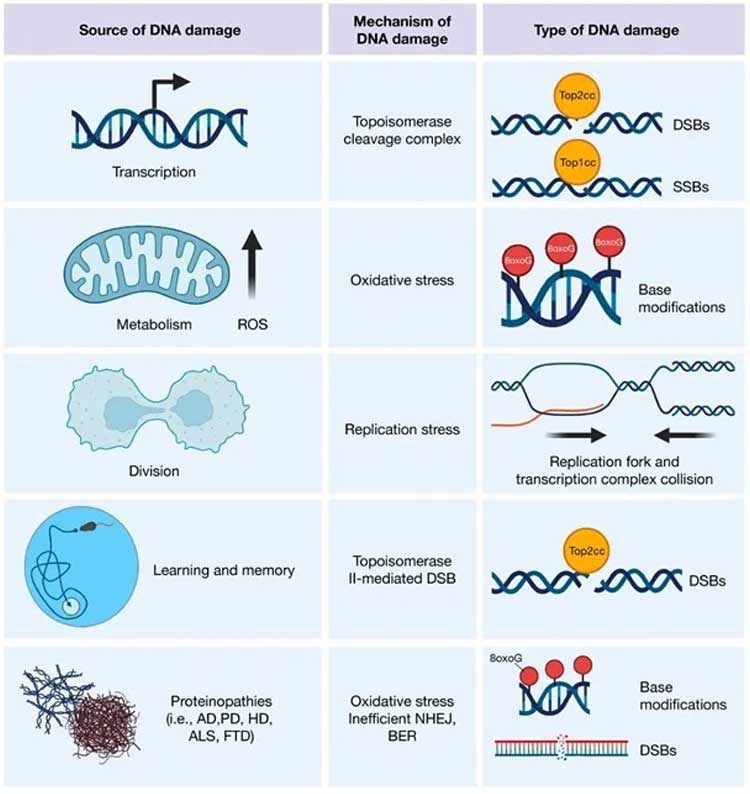
大脑中
DNA 损伤的来源 转录活动可导致拓扑异构酶裂解复合物,从而根据所讨论的拓扑异构酶诱导 SSB 或 DSB。 此外,线粒体的代谢活动会产生
ROS,它可以通过氧化修饰使 DNA 碱基形成疤痕。 虽然在成人大脑中不太常见,但细胞分裂也是 DNA 损伤的来源。
增殖增加了复制叉和转录复合物碰撞的机会,从而诱导了 DSB。 在发育中的大脑中,这对 NPC 来说是一种特殊的风险,NPC
的长基因(这些碰撞最有可能发生的地方)易位增加,这对神经元功能很重要。
认知要求高的任务会招募特定的神经元集合,其可塑性高度依赖于即时的早期基因转录。 因此,神经元产生拓扑异构酶 II 介导的 DSB
以响应学习和记忆。 最后,还发现导致各种神经退行性疾病的蛋白质在 DNA 损伤检测和修复中发挥作用。
单股断裂
大多数基因组 DNA 损伤是由活性氧 (ROS) 介导的,它会导致单链断裂 (SSB)。 该途径主要发生在神经系统中,因为该系统内对线粒体呼吸的需求很高,占人体总摄氧量的五分之一。 线粒体代谢可能引起代谢活动。
ROS 诱导的 SSB 存在直接和间接机制。
对于后者,由于需要修复有毒的 DNA 修饰,例如非常常见的 8-oxo-7,8-二氢鸟嘌呤
(8oxoG),它会破坏基因转录过程,并且如果修复错误会导致突变,加速大脑衰老和疾病。
这是一类称为非大碱基修饰的修饰的一部分,通过碱基切除修复 (BER) 修复,包括切除,以及短补丁或长补丁 SSB 修复(分别为 sp-或
lp-SSBR)。
紫外线诱导的 DNA
损伤是大面积损伤的形式,这些损伤会在空间上扭曲 DNA 螺旋。 这通过两种途径之一启动检测和核苷酸切除修复 (NER)。 直接 SSB
的第三种方法是通过终止拓扑异构酶 I (TOP1) 激活,导致 TOP1 DNA 切割复合物 (Top1cc) 的形成。
在存在氧化性 DNA 损伤的情况下,Top1cc 无法解决,这意味着这是一种特别有毒的神经元损伤形式。 一种称为脊髓小脑性共济失调伴轴突神经病变 (SCAN1) 的遗传病是由于缺乏解决这种损伤的 SSB 修复酶。
双链断裂
双链断裂 (DSB) 可能比 SSB 更不常见,但毒性可能更大,尽管它们在例如产生广泛的 T 细胞 受体和抗体多样性以及减数分裂重组中发挥生理作用。 在积极复制的细胞中,DSB 更常见,可能是因为复制叉与转录复合物发生碰撞。
然而,大多数 DSB 是由于拓扑异构酶裂解复合物的转录过程而发生的。 由于酪氨酰-DNA 磷酸二酯酶 2 (TDP2) 酶的缺失,应立即分解这些复合物的拓扑异构酶 II (TOP2) 切割复合物旨在缓解扭转并暴露某些转录基因,从而导致 DSB 产生。
DSB 修复通过同源末端连接 (NHEJ) 和同源重组
(HR) 进行。 第二种方法使用姐妹染色单体作为模板合成 DNA 修复裂口,因此没有错误,但只能发生在复制细胞或 S 期之后。
因此,大多数有丝分裂后细胞的主要 DSB 修复途径是 NHEJ。 单链退火 (SSA) 是一种替代途径,但与 NHEJ 一样,与 HR
相比更容易出错。
功能中断可能会导致以后的功能障碍
DNA
断裂可能在神经元活动中具有生理作用,但当它们发生在神经元调节序列中时,它们可能会诱导突变和易位,从而导致影响突触信号传导的转录途径的扰动。
一些 DNA 修复绘图技术正在开发或已经在使用,并证实了这一假设。 聚 (ADP-核糖) 聚合酶 1 (PARP1)
和突变的共济失调毛细血管扩张症 (ATM) 是 SSB 和 DSB 的两个主要传感器。
DNA修复综合征引起的神经系统疾病
现在已知许多神经系统疾病是由可遗传的 DNA 损伤疾病引起的,导致年龄相关或神经发育后遗症。 这些包括导致功能丧失和纯粹表现为神经退行性疾病的 SSBR 蛋白突变,包括 1 型和 4 型动眼神经失用症(AOA1、AOA4)的共济失调。
SSBs 也可以形成 DSBs,在神经元中,不能被 HR
修复。 有缺陷的 SSBR 可通过多种机制引发神经毒性。 一方面,没有修复蛋白 XRCC1,PARP1
变得过度活跃,导致聚(ADP-核糖)的积累。 这反过来会耗尽细胞中的 NAD+/ATP,并通过 Parthanatos 途径导致细胞死亡。
已经阐明了 PARP1 诱导的神经毒性的几种机制,包括 DNA 修复的失调、转录的抑制以及 SSB 在调节神经元活动的增强子位点的积累。
由于 ATM 激酶的突变,DSBR
突变还可能导致神经系统综合征,例如共济失调毛细血管扩张症。 与单独的 ATM
基因突变不同,多重突变可能导致神经元基因组不稳定的阈值降低,从而导致神经结构和功能缺陷。
这可能是因为小脑浦肯野细胞具有开放的染色质片段,这些染色质对某些类型的 DNA
破坏修复机制的异常敏感,导致浦肯野细胞基因表达不足以及特征性小脑萎缩和共济失调。
神经退行性疾病和 DNA 损伤
氧化损伤见于衰老和神经变性患者的脑组织,例如帕金森病
(PD) 或阿尔茨海默病 (AD)。 这与 8oxoG 随着年龄的增长而增加有关,组蛋白去乙酰化酶 HDAC1 减轻了这一点。 单核苷酸变异
(SNV) 可能是高 8oxoG 水平的结果,这会在许多水平上干扰基因转录。
这包括抑制转录因子结合、异常 BER 和基因启动子的甲基化。
由此产生的 SNV 积累可能导致有丝分裂后神经元的基因组多样性,导致上述条件下的神经元功能障碍。 在亨廷顿氏病 (HD)
中,标志性的年龄依赖性 CAG 扩增导致纹状体中的毒性变化,这是由于 DNA 修复蛋白检测到重复序列中的氧化或错配碱基,然后触发不必要的修复。
DNA维持基因中的单核苷酸多态性(SNP)可以降低HD的发病年龄,从而影响其严重程度。
重要的是,在所有这些情况下,SSB 和 DSB 都处于高水平,并且在疾病过程中伴随着重要的标志物,例如认知障碍。 这表明 DNA 链断裂可能导致疾病进展。 许多由异常蛋白质生成引起的神经退行性疾病的生物标志物基因都参与了 DDR 通路。
这些和类似的发现“ 已经确定 DNA 断裂是神经退行性疾病的一种机制 。”
此外,对有丝分裂后神经元中 DNA
断裂的全基因组研究表明,这种断裂在影响突触信号传导和神经元功能的调节区域的位置是它们对神经系统产生毒性作用的主要原因。
也就是说,尽管它们具有功能相关性,但如果修复不当,这些断裂可能会通过错误的易位和突变导致基因组易位。
神经炎症
神经炎症是神经退行性疾病的另一个关键特征,是神经毒性的主要介质。 AD 的许多风险基因实际上会影响小胶质细胞的功能,这些基因是大脑中的巨噬细胞,与神经炎症有关。 衰老可能是这种炎症和神经退行性变的驱动因素,类似的信号可能来自 DNA 损伤的神经元。
此类信号可能通过多种来源产生,包括通过衰老和 DNA 损伤(通过 DDR 途径)激活炎症信号,以及由 核酸 传感器环 GMP-AMP(cGAMP) ) 合酶 (cGAS),可激活 IFN 基因刺激物 (STING)。 这会引发多级炎症反应。
细胞溶质 DNA 还激活 TLR9(Toll 样受体 9)或 NLRP3 炎性体,所有这些都会导致神经炎症。
辉骏实力











 实验热线:4006991663
实验热线:4006991663