中文标题:固醇通过APMAP抑制EGFR降解诱导前列腺癌细胞上皮向间质转化
发表期刊:Cancer Research
中科院分区:1区
影响因子:13.312
发表时间:2019年4月
合作单位:中国科学院苏州生物医学工程技术研究所
运用技术:Co-IP-MS/MS,生物信息学分析(由辉骏生物提供技术支持,点击查看详情)
● 研究背景
相比于局限性前列腺癌,转移性前列腺癌无疑是致命的。近来已有报道表明,胆固醇与前列腺癌的发展有关,并可能成为前列腺癌的诊断标记物和治疗靶点。脂肪细胞质膜相关蛋白(APMAP)是一种跨膜蛋白,在脂肪细胞分化和肥胖过程中被特异性诱导,EGFR底物15相关蛋白(EPS15R)被报道可调节EGFR的内化。了解胆固醇在前列腺癌转移中的作用及具体机制,才能够为前列腺癌的治疗提供新的策略。
● 研究结果
1. 胆固醇诱导前列腺癌细胞EMT的发生依赖于ERK1/2的激活
研究者分别对加胆固醇和不加胆固醇处理的前列腺癌细胞进行了EMT标志物检测,结果显示胆固醇处理增加了EMT标志物的迁移、侵袭和表达(图1A-D)。通过对几种调控EMT的信号通路的检测以及后续的ERK1/2抑制剂实验,发现胆固醇治疗下增加的细胞迁移和侵袭在两种ERK抑制剂治疗后发生逆转,这表明ERK信号通路在胆固醇诱导的前列腺癌细胞EMT中是必不可少的(图1E-H)。
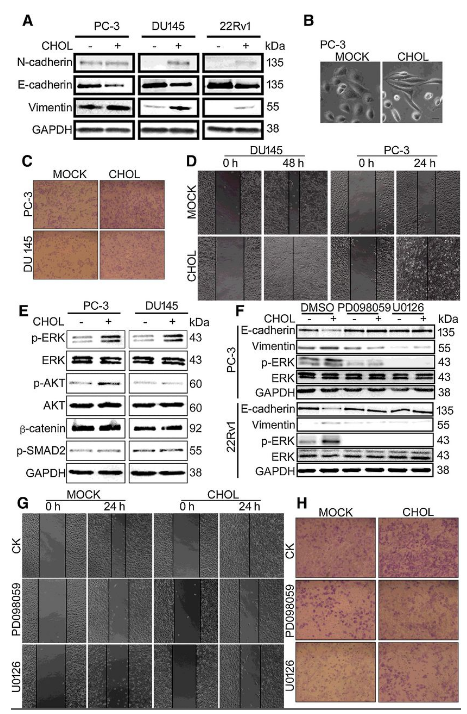
图1
2. 胆固醇促进EGFR和APMAP在脂筏中的积聚
研究者对胆固醇处理下的差异表达基因进行了进一步的GO分析和通路分析,结果显示,这些基因聚集在EGFR、WNT和VEGF信号通路中,这些信号通路都与EMT,此外,GO分析表明胆固醇可能参与了膜筏相关的过程(图2A-B)。LC-MS/MS分析胆固醇处理前后PC-3细胞脂筏蛋白表达的变化,发现ERK1/2的上游调节因子EGFR和结直肠癌转移有关的APMAP在胆固醇处理后的脂筏中均有增加(图2D)。为进一步确定APMAP是否参与EGFR的积聚,将EGFR-RFP载体转染至APMAP缺失的PC-3细胞和对照细胞,然后用胆固醇处理。在对照细胞中,胆固醇增强了EGFR-RFP的荧光;然而当APMAP被敲除后,胆固醇对EGFR的影响几乎完全被抑制(图2F)。同时,APMAP的敲除削弱了EGFR的积累,从而降低了胆固醇诱导ERK1/2的磷酸化(图2G)。这些数据表明,APMAP增加了前列腺癌细胞中由胆固醇诱导的EGFR的蛋白水平。
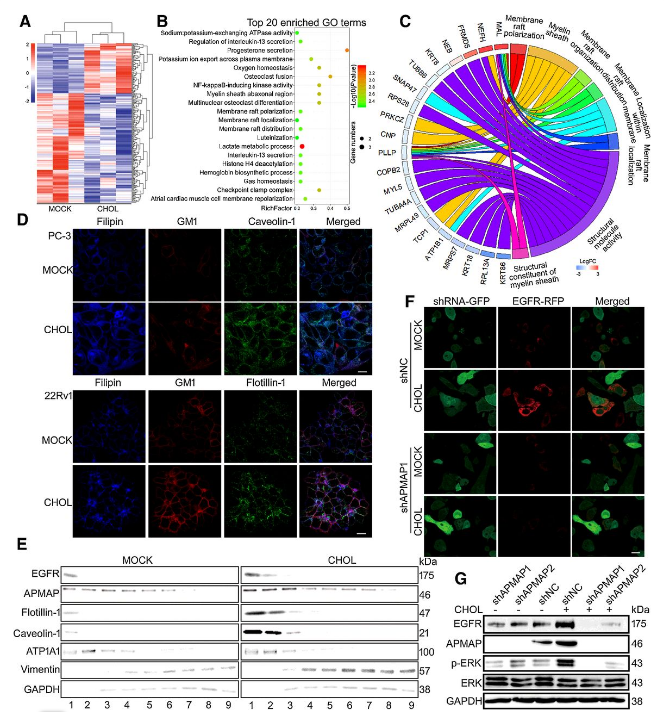
图2
3. APMAP通过EGFR促进前列腺癌细胞EMT
接下来,研究者对APMAP基因敲除后的差异表达基因进行了进一步的GO分析和KEGG通路分析,这些基因与类固醇生物合成和胆固醇代谢过程聚集在一起(图3A),这表明APMAP和胆固醇可能有重叠的功能。APMAP基因敲除显著抑制了胆固醇诱导的细胞迁移、侵袭能力和EMT过程(图3B-D)。相反,APMAP的过表达促进了迁移和侵袭,而EGFR抑制剂则抑制了这一效应(图3E,F)。此外,EGFR抑制剂显著抑制了ERK1/2的激活,并抑制了APMAP过表达细胞中EMT标志物的表达(图3G)。体内实验的结果与之类似,与对照组相比,注射胆固醇组的细胞明显形成更多的肝转移结节。胆固醇组的转移瘤组织中,EGFR mRNA、APMAP和Vimentin的表达水平均显著高于对照组,APMAP基因敲除显著降低了它们的表达水平(图3J,K)。这些数据表明APMAP通过调节EGFR参与胆固醇诱导的EMT过程。
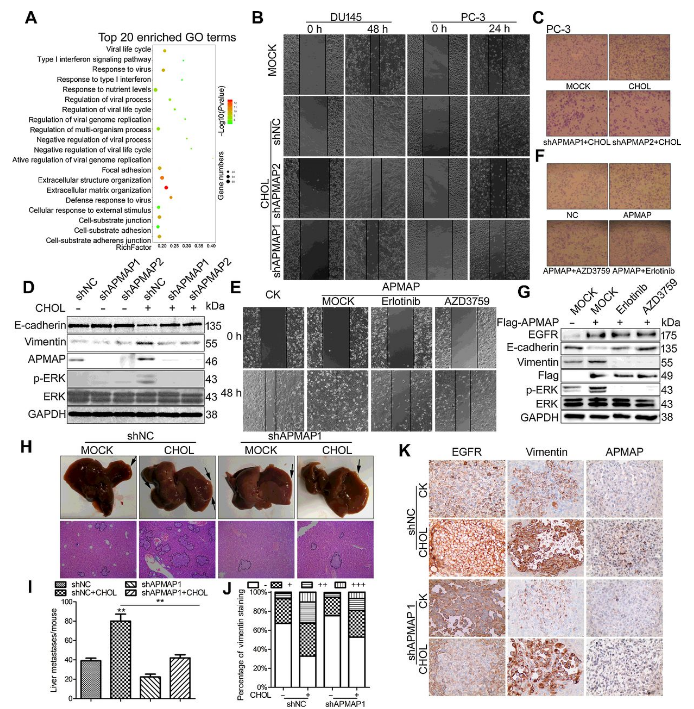
图3
4. 胆固醇通过APMAP降低EGFR的内化
qRT-PCR分析发现胆固醇对EGFR的转录水平没有影响(图4A),这说明APMAP对EGFR水平的调节发生在翻译之后。EGFR的降解依赖于内化,研究者推测胆固醇对EGFR降解的抑制是通过EGFR的内化实现的。共聚焦显微镜显示,在胆固醇处理下,EGFR和早期内体标记Rab5在两个细胞中的共存减少(图4D,E);APMAP-G FP与Rab5-RFP的共存增加(图4F)。转染EGFR-GFP/Rab5-RFP和APMAP-GFP/Rab5-RFP至PC-3细胞,胆固醇处理后,APMAP沉默的细胞中EGFR与Rab5的共存增加(图4G)。这些数据表明,APMAP调节胆固醇介导的EGFR的稳定性。
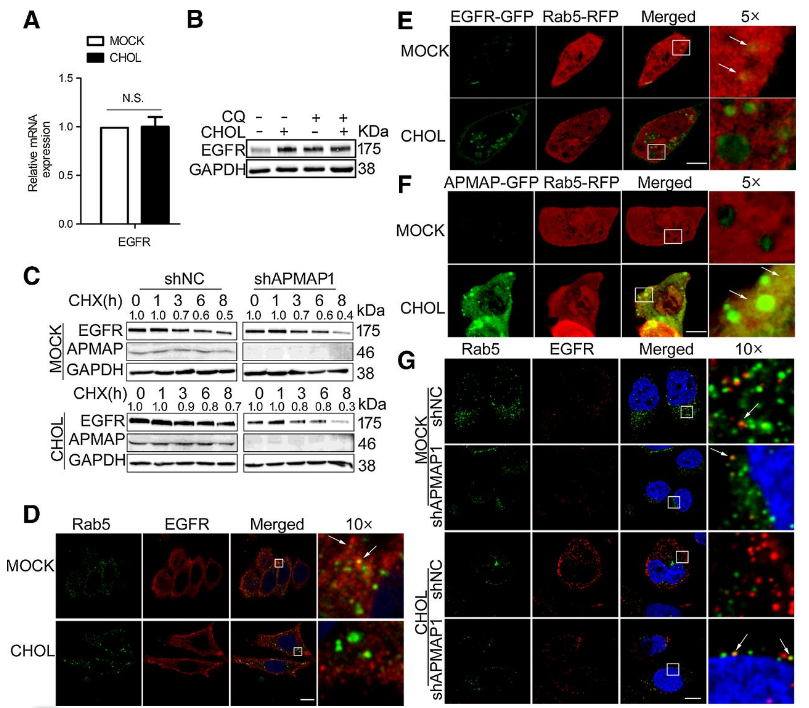
图4
5. APMAP通过与EPS15R相互作用抑制EGFR内化
使用Co-IP和LC/MS-MS分析来确定APMAP的结合伙伴,对检测到的APMAP结合蛋白进行了GO富集和途径分析,数据表明APMAP参与了囊泡的输注和囊泡介导的转运。由于EPS15R参与EGFR的内化,研究者首先通过Co-IP证实了内源性APMAP与EPS15R的相互作用(图5C),发现EPS15R的蛋白水平不受胆固醇的影响(图5D),且质膜免疫荧光显示,这种相互作用通过胆固醇治疗得到加强(图5F),并与EGFR解离(图5G)。根据这些结果,研究者推测EPS15R在APMAP介导的EGFR降解中起关键作用。为验证假设,研究者进行了APMAP沉默和/或EPS15R沉默的胆固醇处理的DU145细胞中EGFR和Rab5的免疫染色,结果显示,APMAP沉默促进EGFR向早期内体募集的作用被EPS15R的沉默)所阻断(图5H)。在有胆固醇存在的APMAP耗竭沉默的细胞中,EGFR的蛋白水平因EPS15R的耗竭而恢复(图5I)。这些结果表明,APMAP通过与EPS15R结合,抑制EGFR内化到早期内小体,从而影响胆固醇诱导的EGFR蛋白稳定性。
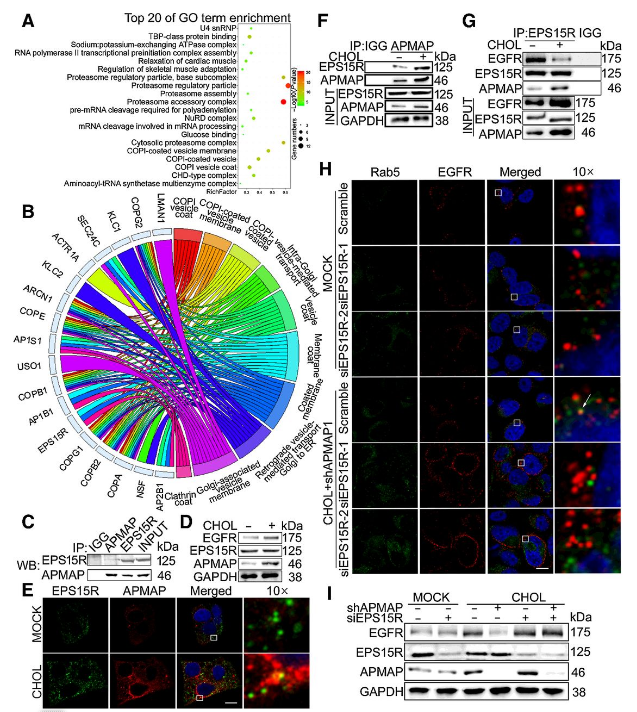
图5
6. APMAP在前列腺癌中显著上调
为了了解APMAP在恶性肿瘤中的作用,研究者对15种癌症中APMAP的转录水平进行了生物信息学分析,发现前列腺癌组织中APMAP的表达均显著高于邻近正常组织(图6B)。ROC曲线分析显示APMAP表达在预测前列腺癌组织与正常组织的敏感性和特异性(图6C)。为探讨APMAP在前列腺癌组织和正常组织中的表达情况,对80例前列腺癌患者和8例正常对照的组织芯片标本进行免疫组化染色。结果显示与正常组织相比,前列腺癌组织中APMAP蛋白的表达增加(图6D)。APMAP在肿瘤中的表达明显增高,说明APMAP可作为前列腺癌的潜在诊断标记物。
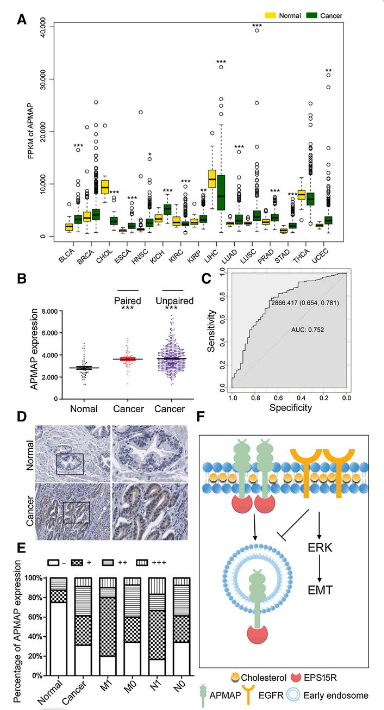
图6









 实验热线:4006991663
实验热线:4006991663










