酒精性脂肪肝病( NAFLD )越来越多地与代谢综合征相关,这是一组促进心血管疾病的代谢功能障碍。NAFLD 涵盖了一系列慢性肝病状态,从脂肪变性开始,最终发展为肝硬化,包括永久性肝组织瘢痕。据估计,NAFLD 的全球患病率超过 30%,平均每年每 1000 人中约有 47 例新病例。总体而言,男性 NAFLD 的年发病率 (~70/1000) 高于女性 (30/1000)。
NAFLD 是全球最常见的慢性肝病类型。尽管目前许多临床研究正在评估针对致病机制的各种候选药物,但尚未有药物被 FDA 批准用于 NAFLD。因此,NAFLD 和非酒精性脂肪性肝炎 (NASH) 患者的治疗依赖于饮食、锻炼、生活方式的改善,以及使用批准用于糖尿病、肥胖症、炎症和氧化应激的药物。
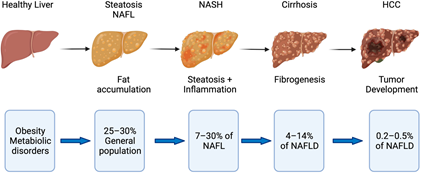
图:脂肪肝疾病的疾病进展,肥胖和代谢紊乱是 NAFLD 的危险因素,它始于肝细胞中的脂肪堆积。进一步的疾病进展以炎症 (NASH) 和随后导致肝硬化的纤维化为特征。伴有和不伴有肝硬化的 NASH 都有发展为肝细胞癌 (HCC) 的风险。
强调 NAFLD 和进展为 NASH 的致病机制
NAFLD 的发病机制被认为是由肝细胞内过多的脂质积累引起的,称为脂肪变性,这是该疾病的一个标志。肝脏脂肪变性的发生是由于肝脏流入和脂肪酸使用的不平衡。脂肪分解、脂肪生成和饮食这三种主要来源在肝脏中的过多脂肪酸积累会导致代谢功能障碍。一旦出现代谢异常,从 NAFLD 到 NASH 的进展会因其他损伤而加速,例如脂毒性和炎症导致肝损伤。
NAFLD 临床研究中的生物治疗药物
许多研究药物,包括小分子和生物治疗药物,正在针对涉及 NAFLD-NASH 发病机制的关键靶点进行临床评估。一些正在评估的生物治疗药物包括蛋白质类似物(例如,FGF19 和 FGF21)、双特异性抗体(例如,FGFR1/KLB)和肽受体激动剂(例如,GLP-1/胰高血糖素)。总体而言,在临床前和临床研究中,基于 FGF19 和 FGF21 的化合物已被证明可以减轻体重并改善脂质代谢。
AAV基因传递方法靶向脂质氧化
在一种新的临床前方法中,弗吉尼亚大学医学院的科学家利用 AVV8 载体来驱动 E06 的单链可变片段 (E06-scFv) 在饮食诱导的 NAFLD/NASH 小鼠模型的肝细胞中的表达。由于在脂肪变性条件下肝脏中会产生过量的自由基氧,因此增加的脂质氧化产物如氧化磷脂酰胆碱 (OxPCs) 是 NAFLD/NASH 病理的一部分。
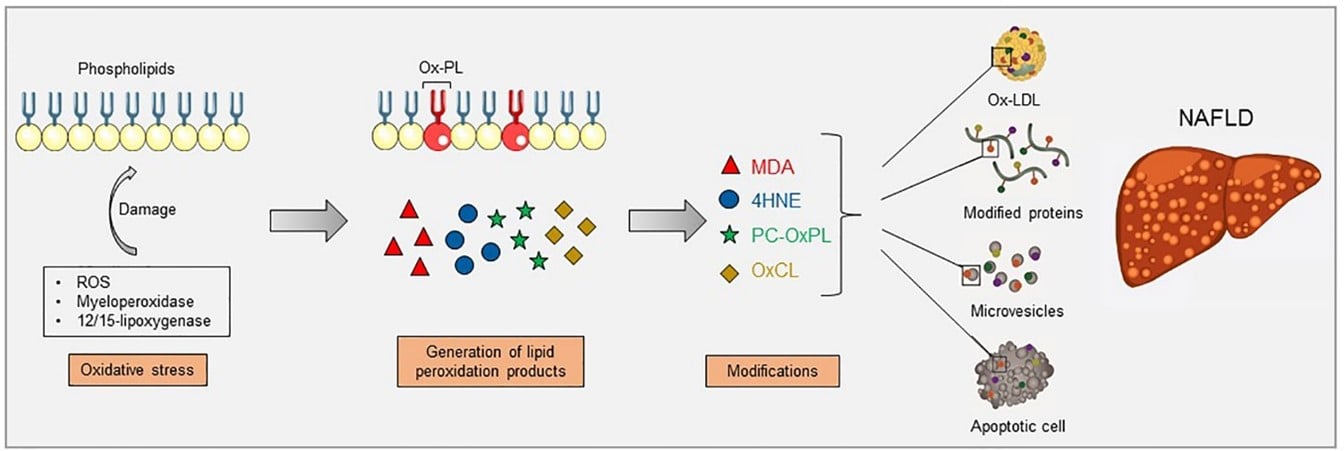
“增加的氧化应激会导致脂质过氧化,这可以通过酶促反应发生,例如髓过氧化物酶和 12/15-脂氧合酶,以及非酶促反应,例如活性氧 (ROS)。膜磷脂的脂质过氧化导致其断裂并产生分解产物,这些分解产物可以进一步修饰蛋白质和脂质的游离氨基,形成共价加合物并产生氧化特异性表位 (OSE),包括丙二醛 (MDA)、4-羟基壬烯醛。 4-HNE)、氧化磷脂上的磷酸胆碱 (PC-OxPL) 和氧化心磷脂 (OxCL)。这些表位由氧化低密度脂蛋白 (OxLDL)、修饰蛋白、微泡和凋亡细胞携带,这些方面已被证明在 NAFLD 期间存在。
E06 是一种天然存在的 IgM,可靶向并中和氧化的磷脂酰胆碱 (OxPC)。加州大学圣地亚哥分校 Joseph Witztum 小组先前的工作证明了使用 E06-scFv 靶向 OxPC 的原理证明。在这些研究中,Witztum 团队证明 E06-scFv 在 NASH 小鼠模型中的转基因表达有效减少了脂肪变性、炎症、纤维化、细胞死亡和线粒体功能障碍,并导致肝细胞中脂质积累减少。因此,Upchurch 等人的工作。利用类似的方法,但不是组成型表达 E06-scFv,该团队依靠使用 AAV8 载体来驱动抗体片段的肝脏表达。
总体而言,这种策略使他们能够阐明早期 AAV8-scFv-E06 表达可以防止脂质积累。相比之下,在建立脂肪变性后,在疾病后期表达 AAV8-scFv-E06 有助于减少纤维化和进展为 NASH。此外,该团队将这些积极成果与特定 OxPC 种类的减少联系起来,提供了进一步了解可能在 NAFLD 起始和进展为 NASH 中发挥作用的分子因素的机会。









 实验热线:4006991663
实验热线:4006991663